regula octetului
copie
1 regula octetului. De ce este format dintr-o conexiune? legătură chimică covalentă, tipuri și mecanisme de formare. Detalii privind legătura covalentă (energia de legătură și polaritatea). legătură ionică. obligațiuni metalice. Legătura de hidrogen Electronegativitate. Starea de oxidare și de valență a elementelor chimice rezolvarea unor sarcini tipice A4, A5
2 tipuri de chimice covalente de legare la metal hidrogen ion interacțiune nepolari polar este atomii legătură chimică, realizate prin schimbul de electroni. Motivul pentru formarea legăturilor chimice câștig în sistemul atomic de energie în comparație cu atomii izolați.
3 + Potențialul energetic -prityazhenie repulsie dependența energetică a energiei potențiale a celor doi atomi ai internuclear comunicație la distanță conexiune Lungime Lungime echilibru internuclear distanță, ceea ce corespunde cu energia potențială minimă de legare. Pe rezistența legăturii este judecat de energia sa. De obicei, energia de legare de înțelegere sau energia eliberată în formarea legăturii de atomi, sau energia minimă necesară pentru a rupe legătura de tip homolitică. distanta internuclear
if ($ this-> show_pages_images $ PAGE_NUM doc [ 'images_node_id'])
4 De ce este format dintr-o conexiune? Atunci când atomii de legare chimică tind să dobândească un vosmielektronnuyu stabil (sau doi electroni) învelișul exterior corespunzătoare structurii atomului cel mai apropiat de gaz inert. Forța motrice pentru provocarea atomii sunt interconectate, este tendința de a accepta sau de a trimite electroni se combină pentru a primi un înveliș exterior de electroni complet umplut (regula octetului).
5 Formarea legăturii ionice atom de legare la metal ionic pierde electroni și devine atom nemetalic. Na 1s 2 2s 2 2p 6 3s 1 - un electron extern Cl 1s 2 2s 2 2p 6 3s 2 3p 5 - șapte electroni extern Dacă atomul de sodiu transmite numai ei Zs-electron atom de clor regula octetului este îndeplinită pentru ambele atomi: Na + Cl - 1s 2s 2 2 2p 6 - opt electroni extern 1s 2s 2 2 2 2p 6 3s 3p 6 - opt electroni extern
6 atomi de legătură Charged ionice formate prin pierderea sau achiziționarea unuia sau mai multor electroni se numesc ioni. ionii pozitivi se numesc cationi și anioni încărcate negativ sunt numite. Atracția ionilor încărcați opus se numește o legătură ionică. Ea apare în compușii formați de metal și unul sau mai multe nemetale: MgCl2, Fel 2, CUF, Na 2 O, Na 2 SO 4. Transferul de electroni din atomul de metal la atom și o formațiune de ioni metaloid este posibilă datorită faptului că nemetale au un electronegativitate ridicat și un metale scăzute. Din cauza puternica atractie a ionilor la fiecare alți compuși ionici sunt în principal solide și au punct de topire relativ ridicat.
7 covalentă legătură covalentă legătură (din cuvântul latin „cu“ împreună și «Văi» având forță) se realizează printr-o pereche de electroni aparținând ambii atomi. 1 1s H - un electron Cl 1s 2s 2 2 2 2p 6 3s 3p 5 - șapte electroni în nivelul exterior, fiecare dintre cei doi atomi îi lipsește un electron pentru a avea un înveliș complet electron exterior. Și fiecare atom de presă, în general, folosesc un singur electron.
8 Există un schimb de legătură covalentă și mecanismul donor-acceptor de formare a legăturii covalente. 1) Mecanismul de schimb. Fiecare atom dă un electron nepereche în ansamblu mecanismul Donor acceptor de electroni pereche 2). Un atom (donor) oferă o pereche de electroni, iar celălalt atom (acceptor) prevede această pereche de liberă orbitale;
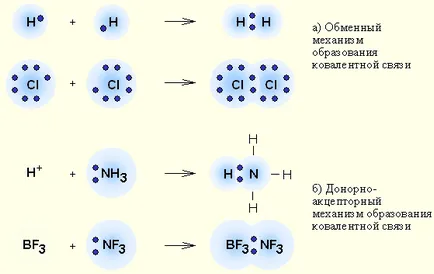
9 Mecanisme de legătură covalentă
10 legătură covalentă polară nepolare dacă densitatea de electroni este situată simetric între atomii, o legătură covalentă este numită nepolară Dacă densitatea de electroni este deplasat spre unul dintre atomii, se numește legătură covalentă polară. Polaritatea conexiunii este mai mare, cu atât mai mare diferența de electronegativitate electronegativitatea atomilor - este capacitatea unui atom de a atrage electroni din altă densitate de atomi. Cele mai electronegative elemente - fluor, cel mai electropozitiv - Franța.
11 comunicare Multiplicitatea Pe lângă legături simple pot forma dublă sau triplă legătură covalentă, cum ar fi în moleculele de oxigen O 2 și azot N 2. Atomii de azot au cinci electroni de valență, prin urmare, este necesar pentru completarea shell are trei electroni. Acest lucru se realizează prin socializare trei perechi de electroni după cum este ilustrat mai jos: compuși covalenți de obicei gaze, lichide sau solide cu punct de topire relativ scăzute
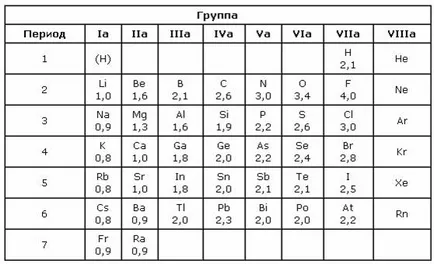
14 electronegativitate elemente de diferență în compusul (Ax) permite să judece tipul legăturii chimice. Dacă valoarea δ X = 0 legătură covalentă nepolară. Când diferența electronegativitate la 2,0 legături covalente polare este numit, de exemplu: F H legătură în molecula de acid fluorhidric HF: δ X = (4,0 2,1) = 1,9 Conexiunile la diferența de electronegativitate mai mare de 2,0 sunt considerate ionic. De exemplu: Na Cl legătură în compusul NaCl: δ X = (3,0 0,9) = 2,1.
Metale de obligațiuni metalice 15 posedă proprietăți specifice diferite de proprietățile altor substanțe. Astfel de proprietăți sunt puncte relativ ridicate de topire, capacitatea de a reflecta lumina, conductivitate termică ridicată și electrice. Aceste caracteristici sunt necesare în existența unui tip special de comunicare lipire metale metalice. bond metal apare ca rezultat al delocalizării electronilor de valență care sunt suficient circula liber în rețeaua metalică, care interacționează cu ionii încărcați pozitiv.
16 Legătura de hidrogen Pauling Scale atom de hidrogen, un atom de fluor legat la atomi de oxigen sau azot pot forma o altă legătură suplimentară. Deoarece, în general, o moleculă puternic pereche de electroni este decalat față de un atom de hidrogen la un element electronegativ, acesta proton reacționează cu o pereche de electroni unshared al unui alt atom, socializarea acestuia. O astfel de legătură chimică numită o legătură de hidrogen. Legarea hidrogenului este interacțiunea dintre doi atomi electronegative de unul sau de molecule diferite de atom de hidrogen: A H B (de mai jos denotă o legătură covalentă, legătură de hidrogen trei puncte).
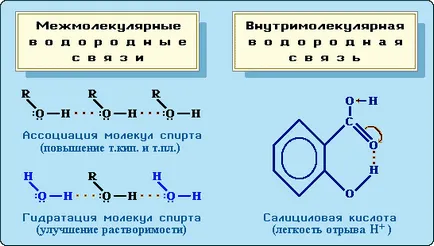
18 Influența legăturilor de hidrogen asupra proprietăților substanțelor Hydrogen afectează legături fizice (p.f. .. volatilitate și vâscozitatea P. t) și chimice (acid-bază) proprietățile compușilor. Legăturile de hidrogen intermoleculare sunt responsabile pentru asocierea moleculelor, rezultând puncte de fierbere mai ridicate și agenți de topire. De exemplu, alcoolul etilic, C 2 H 5 OH, capabilă de asociere, fierbe la 78,3 C, și dimetil eter CH3 och3 nu formează legături de hidrogen numai la -24 C (formula moleculară a ambelor substanțe C 2 H 6 O ). Formarea H legături cu moleculele de solvent se îmbunătățește solubilitatea. Astfel, metil și etil alcooli (CH3 OH, C 2 H 5 OH), formând H legături cu moleculele de apă se dizolvă în aceasta la infinit. legături de hidrogen intramoleculare afectează în mod specific proprietățile. De exemplu, H-legătura în moleculele de acid salicilic crește aciditatea.
19 acid nucleic și elementele de structură secundară de proteină (de exemplu, α-helix, β-ori) și în structura terțiară a moleculelor de proteine, ADN și ARN sunt stabilizate prin legături de hidrogen. In aceste macromolecule, legături de hidrogen interbloca parte din aceeași macromoleculă, determinându-l să se plieze într-o anumită formă.
25 atomi de oxidare Ioni Transition electroni comutatoare electronice nu sunt complet, dar parțial. Imaginați-vă că electronul a trecut complet dintr-un atom de hidrogen la un atom de clor: Ionic bond atracția electrostatică O astfel de oxidare costurile apelurilor condiționate.
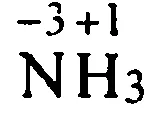
Gradul de oxidare a 26 - această sarcină condiționată a atomului în moleculă, calculată pe ipoteza că molecula este format din ioni și electric neutru ca întreg. Modalitățile de stabilire a gradelor de oxidare: 1. CO orice element dintr-o substanță simplă (H 2, Al, S) este egală cu suma tuturor atomilor CO în moleculă este elementele cele mai electronegative sunt negative în compusul CO, și atomii de elemente cu o electronegativitate inferior - pozitiv. CO 4.Maksimalnaya orice număr grup de elemente egal cu (excepție: cupru, argint, aur, fluor, oxigen), iar minimul este egal cu negativ 8 N unde numărul grupului N.
27 CO constantă: metale alcaline 1 Mg, Be și metal alcalino +2, +3 aluminiu fluorhidric -1 +1 pământ (cu excepția hidruri NaH, CaH2 etc. în care gradul de oxidare a hidrogenului -1.), Oxigen -2 (cu excepția F 2-1 O 2 și peroxizi grupă conținând OO, în care gradul de oxidare cu oxigen -1)
28 grade de oxidare a unor elemente
Exemplul 29. calculează gradele de oxidare
30 atomi de capacitatea de valenta pentru a forma un anumit număr de legături cu alți atomi. Posibilități valenta atomi sunt determinate: numărul de electroni nepereche (Orbitali one electron); prezența orbitali libere; prezența perechilor de electroni neîmpărtășite.
Valenței 32 nu marchează și nu poate fi zero, în timp ce gradul de oxidare necesar și marca caracterizată poate avea o valoare de zero.
33 Se determină valența și oxidarea atomilor de azot în ionului de amoniu NH 4 + Soluție: ionului de amoniu NH 4 + atom de azot formează patru legături simple și atomii de hidrogen, deci azotul este o valență IV. Noi determinăm gradul de oxidare a atomului de azot: x + 4 = + 1; x = + 3; R: este valența azotului IV, precum și gradul de oxidare -3.
34 Se determină valența și oxidarea atomilor de fosfor în acid fosforic H 3 PO 4 (1) 3 + x + (-2) x 4 = 8 = 0 x = 5 x = 5 0
35 Se determină starea de oxidare și valență atomului de azot în acid azotic + 1-2 HNO x + (-2) = 0 3 x = 0 x = 5
36 O valoare mai mare de valență egal cu numărul de orbitali atomice, care atom pot fi utilizate pentru a forma legături covalente. Azot chetyrohvalenten în acid azotic, starea de oxidare +5
37 Formarea de legături între atomii în acidul azotic molecula
39 Scurtă structura lecțiilor de curs pe săptămână (16 webinare) 2. forum închis pentru învățare 3. Monitorizarea periodică a eficienței. 4. înregistrări acces permanent la toate webinarii, sinopsisul și alte. Materiale.
41 Vă mulțumesc pentru atenție! Ne vedem la următoarea lecție!