Phenomena în medii lichide și pe suprafețele interfaciale
Topirea zonei de sudură sunt procese foarte importante în fază lichidă și la interfață.
Faza în chimia fizică a sistemului este numit omogen, otdelennayaot chasteyvidimymi alte interfețe sale.
Fazele in svarkiyavlyayutsyagazovaya miercuri zona lichidă a metalelor zgură zhidkiyitverdy.
Printre cele mai importante procese din zona de sudură otnestivzaimodeystvie faze lichide cu gaze și oxizi.
Dizolvarea gazelor. Să presupunem că sistemul estdvuhfaznaya constând din gaz și faze lichide ale componentelor în fază gazoasă de iod poate fi dizolvat în faza lichidă.
Elemente chimice (gaze) pot crea un lichid compuși chimici sau soluții: în faza lichidă reactanți apar molecule sau ioni moleculari.
Dizolvare: atomi neutri (molecule) ale substanțelor solubile pătrund în grosimea solventului și ocupă spațiu între atomii și moleculele de solvent. Bule.
Între fazele lichidă și de gaz sunt schimbate componente gaz.
La o temperatură dată rata de dizolvare a gazului în faza lichidă poate fi schitatproportsionalnoy davleniyurv faza de gaz parțial,
și rata de îndepărtare a -proportsionalnoy lichid kontsentratsiiSv în fază lichidă.
La echilibru, viteza de dizolvare este rata de îndepărtare.
In starea de echilibru a concentrației gazului în zhidkostiS = k * p unde k -. Henry constantă, care determină solubilitatea unui gaz într-un lichid la temperatura dată P - presiunea parțială a gazului în faza gazoasă, am (concentrațiile indicatorilor de componente Cipyavlyayutsya, respectiv, în lichid și gaz. )
Această relație a fost stabilită și numit legea Henry Henry.
legea lui Henry este valabilă numai la solubilitate scăzută și în cazul gazului eslirastvorenny nu intră lichidul în reacție chimică.
Această lege este aplicabilă ideal și de soluții diluate. Pentru toate componentele (gaze și lichide) sunt limitative valorile maxime de dizolvare (stare de saturație), care depind de temperatură și peste care fluidul nu acceptă gaz.
In cele mai multe cazuri, gazele dizolvate în metalul lichid, cu creșterea limitei de saturație a temperaturii vozrastaet.No se apropie de fierbere - scade. În cazul în care concentrația de gaz în metalul topit la o temperatură dată decât o stare de saturație, excesul începe să iasă în evidență sub formă de bule de gaz (pori).
Metalul lichid pentru a dizolva gazele în stare atomică, iar acele kotoryeimeyut cochilii de valență neumplute (H, N) și nu formează legături cu un ion metalic (cum ar fi oxigenul).
Starea obișnuită a acestor gaze moleculare este, prin urmare, înainte de dizolvare trebuie să sufere de disociere,
Legea de distribuție a materiei în solvenți nemiscibili.
Să considerăm un sistem format din două faze lichide și B nu sunt solubili într-un altul, iar al treilea - faza gazoasă, una dintre componentele care pot dizolva atât în fază și în fazeV. După cum se poate scrie că concentrația de gaz în fiecare dintre fazele la aceeași temperatură, ceea ce implică în conformitate cu Legea lui Henry, că
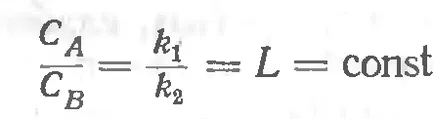
distribuție PostoyannayaLnazyvaetsyakoeffitsientomilikonstantoy, iar raportul este matematic distribuția vyrazheniemzakona Nernst.
Această lege este aplicabilă unei anumite substanțe care se află în orice stare de agregare, dacă este solubil în două în contact cu solvent lichid. Formularea a legii de distribuție este următoarea: Fiecare substanță raspredelyaetsyamezhdu doi solvenți, astfel încât kontsentratsiyego raportul rămâne constantă în ambii solvenți. Trebuie amintit chtoesli în doi solvenți nemiscibili odnovremennomozhet dizolva mai multe substanțe. reciproc necooperarea, tokazhdoe dintre ele vor dizolva independent de celălalt, având o distribuție constantă.
Fuzionării zona de sudură două nemiscibil solvent - un metal lichid și zgura.
Capacitatea anumitor compuși dizolvați în cele două faze utilizate pentru purificarea unor astfel de compuși metalici. De exemplu, la sudarea oțelului în metalul lichid poate suficient fier viguros obrazovyvatsyazakis agravarea proprietăților stali.Zakis de fier ușor solubile nu numai în metalul lichid, dar, de asemenea, în zgură lichidă, iar distribuția acesteia între aceste două proprietăți diferite de lichide este supus dreptului de distribuție.
Condițiile în viitor, pentru a încheia concentrația substanțelor prezente în zgură, în paranteze și substanțe nahodyaschihsyav metal lichid, - în piață, putem scrie
Reducerea concentrației de oxid de fier liber în zgură poate cauza reducerea conținutului său în metalul lichid: metal se va muta în zgură, deoarece pentru o anumită valoare a constantei de distribuție a temperaturii în mod continuu. Și se bazează pe acest metal difuzie dezoxidare.
În același mod, și poate reduce concentrația de sulf din metal. Pe actiunea legii de distribuție este metoda de obținere extrem de rafinat retopire electro-zgură de metale și aliaje pe bază de asemenea.
Conceptul de energie de suprafață.
Diferite procese chimice care au loc în sisteme eterogene, care de obicei începe să crească din suprafețele de separare a fazelor, apoi se deplasează mai departe adânc în sistem.
Condiții pentru existența moleculelor stratului de suprafață sunt diferite de cele în care moleculele sunt straturile interioare. Prin urmare, proprietățile suprafeței deosebesc de proprietățile straturilor interne ale materialului.
Caracteristici proprietăți ale straturilor de suprafață ale substanței sunt afișate pe oricare din interfață, dar
în special de mult - în „lichid - gaz de“ sistem,
mai slabă - la granița dintre două lichide nemiscibile, precum și în „solid - lichid“
chiar și mai slabă - la interfața dintre solide.
Manifestarea acestor proprietăți sunt rezultatul prezenței unei anumite secțiuni privind energia de suprafață a fazelor - energia de suprafață sau energiipoverhnostnogo tensiune.
Tensiunea superficială nu depinde numai de lichid, ci și asupra mediului care este adiacent la acesta, deoarece acest mediu poate influența moleculelor de suprafață lichid. Prin schimbarea mediului de frontieră poate fi foarte puternic influențată de cantitatea de zhidkosti.Veschestva tensiunii superficiale care reduc tensiunea superficială se numesc agenți activi de suprafață, iar substanța afectează slab tensiunea superficială -poverhnostno-inactivă. De exemplu, grupul de metale alcaline și alcalino-pământoase și majoritatea sărurilor formate de acestea se referă la surfactant veschestvam.Etim utilizați în lipirea și sudarea, cu scopul de a realiza o mai bună capacitate de umezire a suprafeței metalului lichid metal solid și mai ușor de dizolvare a picăturilor de electrozi metalici în baia de metal topit.
Tensiunea superficială afectează valorile numerice ale presiunii de vapori și solubilitatea substanței. Dacă lichidul are forma unei picături, picăturile cu o scădere a dimensiunii presiunii de vapori asupra lor uvelichivaetsya.Eto datorită gradului de influență a curburii poverhnosti.Otsyuda volatile rezultă că picăturile mici au întotdeauna o presiune a vaporilor mai mare. decât mare, și, prin urmare, mai ușor decât aerul cu aerosoli isparyayutsya.Osvezhiteli.
În ceea ce privește efectul tensiunii superficiale asupra solubilității, este cunoscut faptul că picăturile mici se dizolvă mai bine decât cele mai mari.
Același lucru se întâmplă și cu granule solide din metal: la temperaturi ridicate, granule mari cresc în detrimentul mici ca mai puțin stabil (când încălzirea boabe mari cresc în detrimentul celor mici).
impact semnificativ asupra valorii tensiunii superficiale are schimbarea temperaturii. O creștere a temperaturii duce la scăderea tensiunii superficiale, ca rezultat al agentului de expansiune atenuat forțele de atracție între molecule în interiorul substanței, iar în stratul său de suprafață.
La o anumită temperatură, tensiunea superficială a fluidului devine zero și dispare partiție între lichid și fazoy.Eta temperaturii gazului numit punct de fierbere absolut sau temperatură critică peste care substanța nu poate fi în stare lichidă.
Natura fenomenelor de adsorbție poate fi explicată după cum urmează. Molecule sau atomi ai substanței situate pe suprafață, au, în contrast cu moleculele și atomii situate în interiorul materialului, liber, nu au ocupat forțele de legare. Dacă o astfel de suprafață va fi, de exemplu, atomii de gaz, ele pot fi păstrate molecule sau atomi ai materialului având forțe libere de legare, adică. E. adsorbit. În cazul în care forțele de legare sunt suficient de mari, atomul adsorbit va rămâne la suprafață, în cazul în care cei slabi - el poate părăsi suprafața materialului.
Creșterea temperaturii la care are loc absorbția datorită energiei crescută a vibrațiilor termice ale particulelor adsorbite duce la faptul că unele dintre ele înapoi în mediul gazos și adsorbție este redusă.
Scăderea temperaturii, dimpotrivă, vyzyvaetvozrastanie adsorbție până când suprafața se formează un strat subțire de gaz câteva straturi moleculare.
În mod similar, cu privire la dezvoltarea efectului de adsorbție și reducerea presiunii: a davleniyaadsorbtsiya coborâre scade.
Atunci când presiunea este crescută crește adsorbție.
În plus față de temperatură și presiune, dezvoltarea procesului de adsorbție este afectată semnificativ de natura substanțelor adsorbite și rastvora.Iz componentele mai puternic adsorbit chimici cei al căror punct și zhidkostvyshe temperatura de evaporare de fierbere. deoarece în condiții normale, acestea sunt mai puțin „active“ (viteza scăzută a moleculelor).
dezvoltarea de adsorbție facilitată de prezența în soluție de agenți activi de suprafață care reduc rastvora.VUS tensiunii superficiale.
procesul de adsorbție durează un timp foarte scurt (o fracțiune de secundă), deplasarea în continuare a suprafeței produsului absorbit în materialul interior este mult mai lent - datorită difuziei sau prin amestecare mecanică.
Conceptul de vâscozitatea lichidelor.
Vâscozitatea sau intern frecare se numește rezistența exercitată de mediul lichid prin mutarea unora dintre părțile sale în raport cu cealaltă. Este cunoscut faptul că atunci când se deplasează fluidul prin canalul (. Figura 89.6) Apreciaza straturi diferite de fluid nu este uniformă: straturile din pereții canalelor vor deplasa mai lent decât intern. mișcare de schimbare a vitezei straturilor de fluid este descrisă de o curbă parabolică (fig. 89 a).
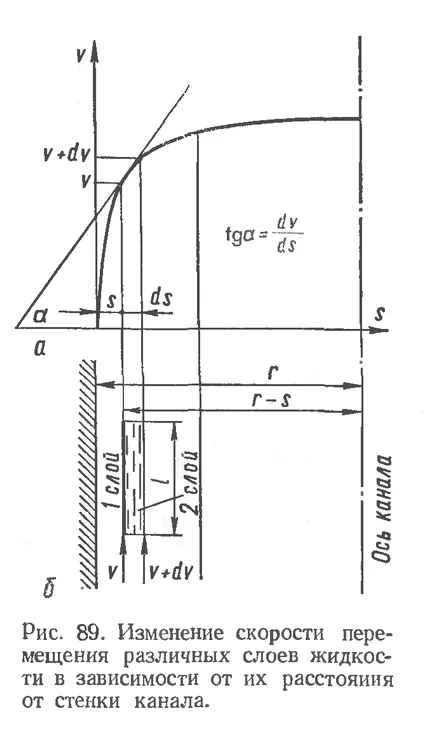
Forța frecarea internă între straturi este determinată de următoarea relație (legea lui Newton): forța de rezistență proporțională cu gradientul vitezei straturilor în mișcare.
în cazul în care F - forța de frecare interioară între sloyamizhidkosti, se deplasează cu viteze diferite, din;
DV / ds - gradientul vitezei ce caracterizează o schimbare a vitezei a straturilor de lichid în direcție perpendiculară pe mișcarea lor, sec-1;
- factor de proporționalitate în funcție de natura, compoziția și temperatura fluidului; El yavlyaetsyakoeffitsientomabsolyutnoy, de asemenea, vâscozitate ilikoeffitsientom vnutrennegotreniya.
Unitatea de lichide cu viscozitate absolute - poise (pz) - Vâscozitatea adoptate a unui astfel de lichid, în care forța se mută stratul de lichid Idin 1cm2 în ceea ce privește un alt astfel de strat, situat la o distanță de primele 1 cm, la o viteză de 1 cm / sec.
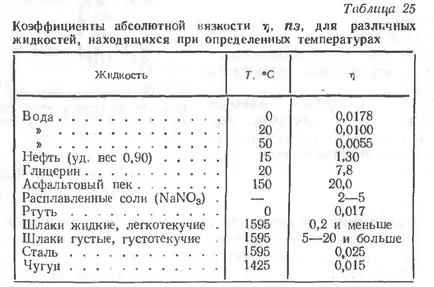
In procesul de sudare, desigur, cel mai interesant este vâscozitatea zgurii formată pe suprafața metalului topit, deoarece mărimea acestui indice și natura modificării procesului de sudare utilizat depinde de proprietățile tehnologice ale acoperirilor și flux, gradul de finalizare a proceselor metalurgice, și așa mai departe. N.
Vîscozitatea de lichide și de sudare zgură, în special, este foarte dependentă de temperatură și, în general, scade odată cu creșterea acesteia. Odată cu creșterea temperaturii zgurii, reducând vâscozitatea acestuia, trec prin trei stări caracteristice:
1 - vâscozitate corespunzătoare casant > 13 octombrie pz;
3 - curgător - la <10 пз.
Pentru a determina vâscozitatea zgurii lichide utilizate un instrument numit viscozimetru.
1. Metoda Ball picătură se bazează pe măsurarea vitezei de cădere a balonului de platină în lichidul de probă. În acest caz, coeficientul de viscozitate se determină prin formula lui Stokes.
2. Metoda rotației cilindrului are mai multe variante, dintre care una este o măsurare a vitezei de rotație a cilindrului eșantionului lichid prin acțiunea unui cuplu specific. Viscozimetru este calibrat pe lichidul a cărui vâscozitate este cunoscută (soluții de zahăr, glicerol).
Vaporii de orice creșteri de substanță cu creșterea temperaturii.
Presiunea vaporilor - presiunea parțială a vaporilor chimici din aer, care este într-o stare lichidă sau solidă, este în contact cu aerul.
Procesul de formare a unui vapori la temperaturi sub punctul de topire al substanței este numit sublimare (sublimare) peste punctul de topire - evaporare.
După evaporare, împreună cu eliberarea particulelor din lichid. proporțional cu numărul lor pe suprafața fazei lichide, există un proces invers - pentru a le reveni din faza gazoasă în lichid. De aceea vaporii opredelennoyuprugosti deasupra lichidului va fi responsabil de contragreutate aceste două procese.
Creșterea umidității prin utilizarea de hidratare si acvarii.
Temperatura la care presiunea de vapori este egală cu presiunea aerului înconjurător, denumit punctul de fierbere. Vaporizarea la această temperatură nu mai este doar pe suprafața liberă, dar tot volumul de lichid. Tabel. 26 arată punctul de fierbere și căldura latentă specifică de vaporizare pentru unele elemente.
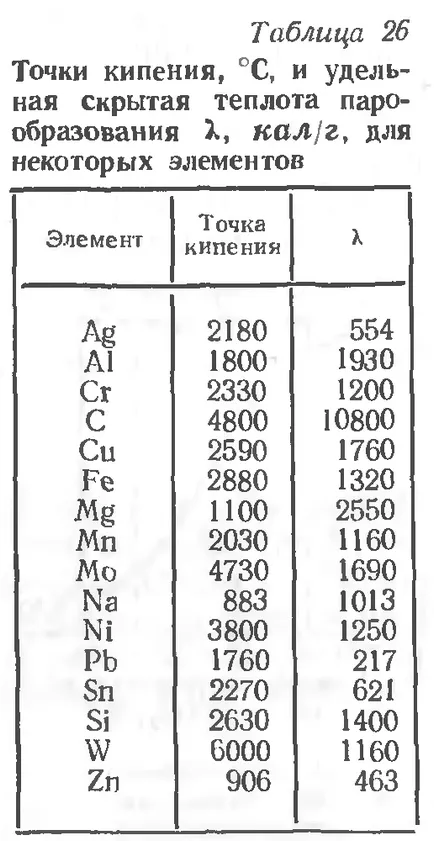
Tabel. Rezultă că unele metale se fierbe la o temperatură care este caracteristic pentru descărcarea arcului. Prezența vaporilor metalici în zona de arc (presiunea vaporilor) contribuie la unul dintre electrod metalic de transfer specii pe produs - transferul vaporilor de metal.
căldura latentă specifică a vaporizării este dependentă de temperatură și presiune. Această dependență poate fi determinată pe baza legilor termodinamicii. Dar de intrare complexitate de calcul și lipsa de valori exacte ale constantelor care definesc presiunea de vapori, sunt adesea limitate la ecuațiile aproximativ aproximative construite pe baza datelor experimentale pentru mai multe temperaturi.
Căldura de vaporizare dintr-un solid, m. E. volatilizare sau sublimare, egală cu suma căldurilor de topire și vaporizarea.
Tot ceea ce a fost aplicat substanțelor pure. Fenomenul devine mult mai complicat pentru un amestec de substanțe diferite.
Atmosfera de gaz în timpul sudării sub formă de metal, cu excepția componentelor aerului. o pereche de compuși metalici și chimici. membrii acoperirilor cu electrozi sau fluxuri. și a produselor de descompunere a acestora.
Transferul vaporilor de metal este condiții datorită neglijabile .În arc temperaturi ridicate descărcare toate metalele care au o presiune de vapori ridicată, ar părea, trebuie să fie în stare gazoasă. Cu toate acestea, rata de evaporare este finit, transfer de metal sub formă de picături prin diferența de arc este foarte rapid și, prin urmare, în timpul fierberii zbor de picături și doar parțial vaporizat.
Pierderea alierea elementovza iokisleniya prin evaporare.
Elemente cu punct de fierbere ridicat și o presiune de vapori scăzută vaporiza mai puțin intensă (de exemplu, W, Ni).
Pe de altă parte, elementele care au un punct de fierbere scăzut și presiune de vapori ridicată, se evaporă mai degrabă viguros (Zn, K, Na, Ca, Mg, Mn, etc.).
Astfel, pentru o creștere a calciului temperaturii 100-200 ° C determină o creștere a presiunii de vapori în sute. la aceeași creștere a temperaturii vremyadlya de fier la 300 ° C conduce la o creștere a presiunii de vapori de numai 10 ori.