Osmoza - un
(Din greacă. -tolchok, presiunea), migrația spontană în insule printr-o membrană semipermeabilă, care separă cele două p-ra dec. concentrare sau pur p-ERATOR și p-p. Naib. de multe ori există o tranziție p-ERATOR printr-o membrană semipermeabilă impermeabilă la cantitatea dizolvată. transfer de masă spontană are loc ca urmare a acestui produs chimic. potențial p-ERATOR scade odată cu creșterea concentrației de substanță dizolvată în insule.
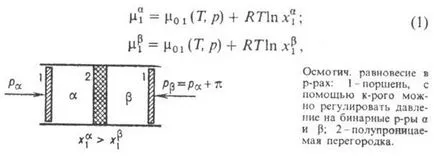
Luați în considerare două molecule de volum și r-ra (vezi. Fig.), Separate printr-o membrană semipermeabilă, molecula permeabilă p-ERATOR (componenta 1) și impermeabile binare dizolvate în insule (componenta 2). Dacă t-T ra și presiunea RPO ambele părți ale peretelui despărțitor sunt aceleași (T = T) și fracțiile molare diferite (), conexiunea (T, p)> (T, p). Pentru diluata ideală sau puternic reală p-șanț unde, op. potențial de pur p-ERATOR, constanta de gaz R-. Când sistemul este termodinamic non-echilibru și, în consecință, există o tranziție de la volumul componentei 1 în volum, atâta timp cât fracția molară în ambele volume sunt aceleași. Pentru a preveni concentrațiile de transfer și de aliniere în masă și de a salva de inițializare. compoziția ambelor p-ing, este necesar să se egalizeze Chem. Componenta 1 potențiale pe ambele părți ale ext schimbare partiție. condiții (t-turii, presiune, ext. electrice. câmp, în cazul electroliților p pax). Izoterme. condiții pentru a păstra compoziția fazei a necesității de a modifica presiunea asupra uneia dintre p-șanțului. Din termodinamica se știe că
în care -partsialny molar cantitate p-ERATOR. Pentru diluata ideale sau foarte reale p-moat. în care volumul -molyarny de pur p-ERATOR. Semn al derivatului este pozitiv și prin creșterea presiunii aplicate la p-ru, Chem. potențialul p-ERATOR va crește. Suplimentară. presiune. la-Roe ar trebui să fie aplicat la p-py pentru a preveni intrarea în ERATOR său districtul prin membrana semipermeabilă p-pa, numit. osmotich. presiune. La o presiune a sistemului este în echilibru termodinamic:
În cazul în care. echilibru este perturbat și există un transfer de p-ERATOR a mai concentrat. r-ra în mai puțin concentrată. Acest fenomen titluri. osmoza inversă; Este foarte practic. aplicarea în separare prin membrană prelucrează într-un.
Pentru dependența ideală de osmotich p-moat. Presiunea asupra compoziției exprimate ur-niem:
unde presiunea p -partsialnye-ERATOR în fazele și. În cazul în care faza este net p-ERATOR, r. F .. atunci; ur-set devine cunoscut sub numele de set-ur Van Laar:
Din aceasta rezultă că osmotich. presiune r-ra ln x1 .Etoy proporțională cu amplitudinea proporțională cu scăderea congelarea t-ry și creșterea T-riu de fierbere ideală p-moat (vezi. Legea lui Raoult), care indică relația dintre aceste fenomene și O.
Dacă concentrația insulelor dizolvate drăguț, dependență osmotich. Presiunea din concentrația sa molară 2> exprimată ur-niem van't Hoff:
Acest ur-set este folosit în general pentru a calcula osmotich. presiune binară p-santul in nedissotsiiruyuschih-in. Cu toate acestea, cel mai bun acord între valorile calculate și experimentale într-o gamă largă de concentrații. câmp oferă ur-set Van Laar (vezi. Tabelul.). La metodele și tehnicile de măsurare osmotich. presiune cm. osmometrie.
Chimice Enciclopedia. - M. sovietic Enciclopedia. Ed. I. L. Knunyantsa. 1988.