Umflarea hidrogenul bilă
Umflarea hidrogenul bilă
Hidrogenul - este de gaz extrem de ușor - acesta este de 14 ori mai ușor decât aerul și jumătate din greutatea de heliu. În cazul în care umfla o minge de cauciuc, el va zbura în sus. Această proprietate a hidrogenului utilizat în trecut pentru umplerea baloane și dirijabile.
Astăzi vom produce hidrogen prin mijloace chimice din materiale ușor accesibile și forța musca mingea.
Am studiat mai multe modalități de a produce hidrogen prin reacție chimică. La alegerea, am pornit de la prezența reactivilor și de securitate disponibile. Și cel mai simplu mod de a obține hidrogen în casă - o reacție de aluminiu, sulfat de cupru și sare alimentară în apă (Al + CuSO4 + NaCl + H2O).
Pentru experiment, avem nevoie de următoarele echipamente: o sticlă de plastic de 1 litru, picurătorul (disponibil la orice farmacie pentru un ban), sulfat de cupru (în bunuri gospodării în departamentul de îngrășământ pentru plante), sare, folie de aluminiu alimentar (sau sârmă din aluminiu), o minge gonflabilă.
Într-un blocaj de trafic pe o sticlă de plastic pe o placă încălzită cu un cui punch. In gaura insera un conector de plastic pe picurător și lipici (am folosit superglue). Apoi ne-am pus pe Dropper țeavă conector. Capătul gros picurÅtorului tăiat, așa cum se arată în figură. Pe ea am pus o minge de cauciuc.
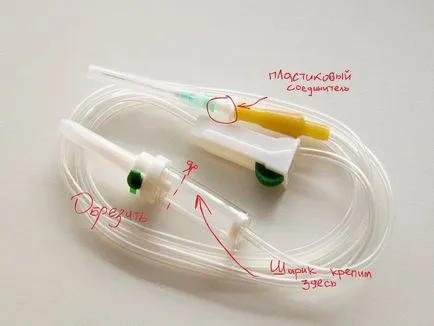
In litru sticla de plastic turnat cantitate egală de sulfat de cupru și sare alimentară (100g, săruri de mult posibil).
Apoi, umplut cu apă (aproximativ 700 ml) și se agită până la dizolvare completă.
Soluția a fost colorată într-o culoare verde strălucitor.
În continuare, trebuie să se pregătească bucăți de folie de aluminiu de produse alimentare (de exemplu dimensiune încât să treacă ușor și rapid în gâtul sticlei). Dacă există sârmă de aluminiu, se folosesc (aproximativ doi metri de sârmă de aluminiu în zig-zag ori, pentru a obține o grămadă de ușor de a urca într-o sticlă). Am folosit atât, și multe altele.
Flaconul cu soluție de sulfat de cupru și săruri necesare pentru a pune în prealabil într-un recipient cu apă (tigaie sau o galeata). Deoarece în timpul sticlei de reacție va fi fierbinte și se poate topi. (De asemenea, soluția poate fierbe rapid, fără răcire și sari înainte de a închide mufa. Testat!).
Apoi, arunca într-o sticlă de sârmă și folie, și a pregătit pentru a închide capacul cu o țeavă. Ar trebui să se facă rapid, deoarece reacția începe imediat și hidrogen începe să iasă în evidență imediat.
Noi uitam bulele de hidrogen formate în jurul unei multitudini de aluminiu. Deasupra suprafeței soluției este vizibil vapori de fum alb. În reacția de o cantitate mare de căldură și încălzește sticla nostru. De-a lungul timpului, culoarea soluției a fost schimbat la o mai inchisa, iar apoi devine negru. aluminiu colorat în culoarea cocoloașe rugina-portocaliu. Este de la ei de cupru din soluție de sulfat de cupru.
Prin gaura din dopul din tub, hidrogenul intră într-o minge. Bulb treptat umplut cu hidrogen și după 10-20 minute, reacția este deja vizibilă deoarece se ridică în aer.
Notă: Pentru ca mingea ar trebui să fie mai ușor umflate cu hidrogen înainte de experiment a inceput sa întindere, și anume umflă și se dezumflă în mod repetat.
Cum funcționează (reacție chimică):
Aluminiu - metale active. În forma sa pură, reacționează cu apă, dizolvat în acesta, hidrogenul este eliberat. Dar, dacă arunci aluminiul în apă, s-a observat nici o reacție. De ce. Și toate pentru că filmul de oxid de aluminiu este protejat. Pentru reacție a început să fie distrus acest film. Sub acțiunea de sulfat de cupru (CuSO 4) + sare dietetice (NaCl), acest film de oxid este distrus, iar aluminiul reacționează cu apa pentru a forma hidrogen H2 și hidroxid de aluminiu, Al (OH) 3.
sulfatul de cupru și clorură de sodiu formează un complex. Soluția sa transformat verde strălucitor.
2) rezultată clorură de cupru CuCl 4 distruge pelicula de oxid de aluminiu.
Aceasta se produce aluminiu reacționează cu apa pentru a elibera hidrogen gazos (H2).
1) CuSO4 + 4NaCl<=> Na2 [CuCl4] + Na2SO4
sulfatul de cupru și clorură de sodiu formează un complex. Soluția sa transformat verde strălucitor.
2) rezultată CuCl4 clorură de cupru distruge pelicula de oxid de aluminiu.
3) 2AL + 6 H2O = 2 Al (OH) 3 + 3 H2 ↑
Acesta apare Reacționează aluminiu cu apă pentru a elibera hidrogen gazos (H2).