Termodinamica celulei electrochimice
Celulele galvanice (Fig. 1) reacție chimică pe electrozi apar mai lent decât rezistența mare are circuit extern. În principiu, puteți închide conductorul electrodului de o rezistență infinit de mare, iar reacția se va proceda la infinit lent, astfel încât în fiecare moment va exista un echilibru între electrozii și soluția. Un astfel de flux de reacție este reversibilă. În cazul unui pro-cesiuni termodinamic reversibil obține activitatea electrică maximă. Acesta este egal cu elementul CEM (E) înmulțit cu încărcătura transportată. Dacă reacția are loc la reducerea timpului și oxidarea z moli de ioni încărcați individual, conform legii lui Faraday M., taxa este transferat zf, unde numărul de F- Faraday. munca electrică la procesul izobară-izotermă se face în detrimentul pierderii energiei libere Gibbs, așa - # 8710; G = zFE.Podstaviv această expresie în ecuația Gibbs - Helmholtz obține -zFE = # 8710; Hr -T # 8710; Sr. Deoarece pentru p = const și # 8710; G = -zFE, get
Derivata numita temperatură koeffitsientomEDS. În funcție de natura celulei poate fi pozitiv sau negativ.
Ecuația (7) permite calcularea teplovoyeffekt de reacție care apare elementul vgalvanicheskom, prin măsurarea coeficientului emf și temperatură. Pentru a determina constanta de echilibru a acestei ecuații de reacție utilizând
și E 0 - emf standard, atunci când activitatea medie a tuturor ionilor din soluție sunt egale cu unu. De la (8) rezultă că
Dacă activitatea ionilor care participă la reacția electrochimică, nu sunt egale cu unu, apoi pentru a evalua pierderea de energie Gibbs în loc de ecuația (8) se utilizează izoterme ecuație
De exemplu, pentru reacția
Din expresia generală pentru electromotoare a celulei
unde E ° - lanț emf etalon.
Curge o reacție chimică în celula poate fi divizată în două reacții conjugate au loc în separat poluele-Menten și. Corespunzător-guvernamentale și expresii pentru potențialele de electrod individuale (# 966; 1 și # 966, 2) pot fi preparați folosind ecuațiile izoterme:
unde # 966; 1 și # 966; 2 - Potențialele de electrod standard.
Pe electrozii metalici de obicei, reacții de tip M z + + ze - ↔M.
În conformitate cu această reacție, și luând în considerare faptul că activ unicitatii solid (metal) la o temperatură dată este constantă și este egal cu unitatea, expresia se obține pentru potențialul de electrod, în raport cu cationul metalic reversibil:
Dacă procedeul implică anioni tokoopredelyayuschem, conform reacției A + ZE - ↔A z -. obține o expresie pentru potențialul de electrod unic, reversibil în raport cu anionul:
(Activitatea formei oxidate a anionului este luat ca o unitate).
Expresia pentru potențialul total al electrodului sub forma
Nernst a fost derivat. Această ecuație arată că potențialul electrodului # 966; depinde de natura sa (natura se caracterizează prin capacitatea standard de # 966; 0), activitatea de ioni în soluție și temperatura.
potențial standard # 966; 0 depinde de natura electrodului și ha caracterizează activitatea electrochimică. Pentru acest Ras-solvent și temperatura țintă a cantității standard Tial este constantă poten. valoarea absolută # 966; 0 nu poate fi determinată, ca prin utilizarea unui voltmetru pentru a măsura numai diferența Poten-Tial doi electrozi. Prin urmare, pentru a măsura # 966; 0 până element al unui electrod standard de hidrogen (EA), care potențial este luat în mod convențional ca zero la toate temperaturile, iar electrodul standard de testare. BOO este prezentată în Fig. 2. Se compune dintr-o placă de platină într-o soluție de acid a redus cu o activitate de ioni de hidrogen al unității. placă de platină manual este sub curent de hidrogen gazos este dată de presurizat 1,013-10 5 Pa (1 atm), la o temperatură constantă.
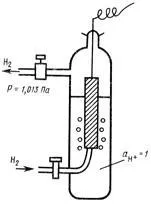
Fig. 2. Electrod hidrogen Standard.
Capacitatea fizică a unui punct standard poate fi setat cu ajutorul ecuației
în care - potențialul de electrod, - un potențial de contact; - (difuziv) potențialul lichid.
Dacă în această ecuație. celula forță electromotoare este potențialul de electrod standard de:
Acest lucru înseamnă că potențialul de electrod standard include con-accident vascular cerebral și a potențialului de difuzie neînregistrată, adică. E. conține o valoare incomensurabilă și, prin urmare, nu este absolută. Cu toate acestea, se definește cu precizie în condiții standard ale energiei standard, Gibbs a unei reacții redox care are loc la electrodul. Astfel, potențialul standard, (în raport cu EA) ia potențialul electrodului cu activitatea ionului egal cu unitatea, în condiții standard. deoarece # 966; pini inclus în potențialul standard elec-trodes și # 966; diferențial pentru a minimiza puterea în puntea de sare, expresia pentru elementul EMF ia forma
Măsurarea p = 1,013 • 10 5 Pa și T = 298 K Element CEM BOO-standard mill și electrodul de test, un semi-chayut # 966; 0 electrodului de test la scara nativ-apă.
Potențialele-ly standard, plasat într-o anumită ordine pentru a forma un număr de tensiuni (scara de hidrogen).
Cu excepția cazului în jumătate de celulă, care includ două metale diferite-la, a crea o celulă galvanică, cea mai mare poziționată în seria electrochimică, comparativ cu metalul dispus mai jos vor avea un potențial negativ. Atunci când scăderea potențialelor potențiale mai pozitive mai negative, indiferent de semne pescuit obținut întotdeauna pozitiv electromotoare.
Cunoașterea potențialelor de electrod standard, se poate calcula cu potențial Semicelulă oricăror potențiale ioni activi.
- elemente care funcționează în mod reversibil aceste elemente, în care, după deschiderea circuitului pentru fiecare electrod este stabilit echilibrul. Reacția reversibilă poate opri elementul prin conectarea sursei de alimentare externă cu aceeași valoare a CEM, dar direcția opusă. Dacă vom crește sursa de curent EMF-extern are o cantitate mică, reacția va merge la inversa direcția. În cazul în care are loc trecerea curentului electric în diferite direcții pe suprafața electrodului, aceeași reacție, dar în direcții opuse, acești electrozi sunt numite Obra-timymi. Un exemplu al unei celule este reversibil consideram anterior renny elementul Jacobi - Daniel, în care atunci când direcția actuală a Zn reacție + Cu 2+ = Zn 2+ + Cu modificări la bord. Cu electrod | CuSO4 este reversibil, deoarece
direcția fluxului de curent alternativ a reacției Cu 2+ + 2e - → Cu 0 și Cu 0 -2E - → Cu 2+.
Dacă procesul de circuit deschis la electrozi continuu etsya, iar când schimbarea direcției curentului electric versus cabine, alte reacții nu invers unul cu altul, elementele sunt Xia ireversibile. Un exemplu al unui element de circuit ireversibil este Volta
În care în funcțiune procesul de oxidare are loc anod zinc
și pe catod - procesul de recuperare a ionilor de hidrogen
Atunci când este aplicat un astfel de element oppositely direcționat CEM, chiar și cu o cantitate infima care depășește EMF elementului, electrozii vor fi procese complet diferite. Deoarece electrodul negativ, care este acum în electroliza va fi numită catod, reacția de reducere va H +.
2H + + 2 e --- H2. și pe pozitiv (anod se va dizolva în electroliza (și oxidat)) cupru
Conform proprietăților substanțelor Operatorul care apar în lan-potențiale de determinare a proceselor, precum și electrozii reversibili toate DISPOZITIV stvu sunt împărțite în următoarele grupe: primii electrozi și al doilea tip, electrozii redox și schimbul de ioni.
1. Electrozii de primul tip. Electrodul de hidrogen gazos.
Pentru electrozii primul tip includ electrozi metalici, relativ reversibil cationilor și metaloid, reversibile în ceea ce privește anioni. Reversibilitatea electrodului în raport cu ionul sau alte mijloace de potențială dependență față de concentrația ionilor de date. Exemple de electrozi de tip M din metal | M + z sunt uitam cursele anterior-Zn ° | Zn2 +. Cu 0 | Cu 2+. Ag ¨ | Ag + și altele. Electrodul-ny potențialul lor dată de ecuația (10) și depinde numai de concentrația (activitatea) un tip de ioni metalici. Pentru electrozi, anionii relativi reversibile se aplică ecuația (11). Un exemplu de electrod metaloid reversibil anion relativ-telno poate servi ca seleniu electrod Se | Se 2-.
Pentru electrozii primul tip includ, de asemenea, electrozi de gaz, care pot fi reversibile în raport cu cationul sau anion. Acestea sunt create de schema (metal) gaz | soluție. Metalul în elec-trodes de gaz necesar ca purtător de electroni și pentru a crea pe suprafață, la care reacția are loc. Metalul trebuie să fie inert față de substanțele în soluție. exemplu Ti-tipic este un electrod de hidrogen gaz elec-trodes (Pt) H2 | H +. Anterior (Fig.2) electrod de hidrogen stan-dard a fost examinat.
potențial electrod de hidrogen depinde de temperatură, de con centrarea ionilor de hidrogen în soluție și presiunea hidrogenului pe suprafața electrodului. Dacă reacția de electrod are loc 2H + + 2e - → H 2.
în care: - presiunea parțială a hidrogenului la suprafața electrodului, aproximativ egală cu 1. Deoarece.
electrod de hidrogen dă o valoare potențială reproductibil. Un dezavantaj este mare sensibilitatea la condițiile de muncă: gradul necesar de puritate ridicată de hidrogen, cu activ de suprafață absența platină distanță de oxidanți și-Solicitanții au crescut în soluția de testare.