Nomenclatura și izomerie Arenes
Cel mai simplu reprezentant al Arene este benzen. Ras viziona mai multe dintre proprietățile sale.
Benzenul este un lichid incolor limpede, legkole-tuchuyu cu un miros caracteristic (este din cauza mirosului puternic de compuși aromatici derivă lor de găzduire Project-set). Punct de topire 5.5 ° C, punctul de fierbere - 80 ° C Acesta este nemiscibil cu apa, dar este miscibil cu cel mai bine ically solvent organi. Este un solvent pentru substanțe organice nepolare. flacără Smoky arde (parțială chiar mai devreme-combustie) pentru a forma, pe lângă dioxid de carbon și apă, cantități considerabile de funingine-TION. Toxic și ca lichid și sub formă de vapori prin inhalare.
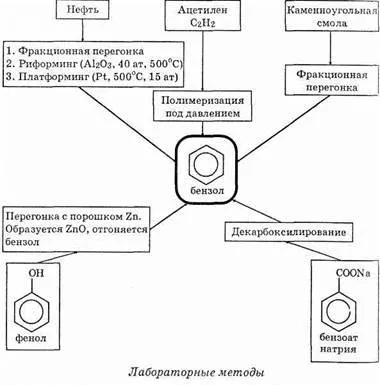
1. în benzen industria petrolului obținut de reformare,-Koto ing în esență un ulei alcani dehidrogenare pentru a forma un schelet ciclic. In viespi formă „pure“ novnaya reacției de reformare - este dehidrogenarea hexan:
Mai mult decât atât, benzen este un produse volatile Kok-popping. Cocsificabil - cărbune este încălzit la 1000 ° C, fără accesul aerului. S-au obținut ca mulți alți reactivi valoroși pentru sinteza organică și cocs metalurgic ispol'uet-zable. De asemenea, benzen poate fi preparat prin trimerizarea acetilenei peste carbon activat la 100 ° C,
2. Benzenul de laborator, desigur, nu este obținut, dar metodele teoretiches-ki pentru sinteza sa este (acestea sunt utilizate pentru obținerea derivaților săi). Și metode industriale și de laborator sunt reflectate în diagrama de mai jos.
Metode de antrenare pentru producerea de benzen
Proprietățile chimice ale benzenului
Proprietățile chimice ale benzenului sunt determinate, desigur, sistem p său. La fel ca și în cazul alchenelor, acesta poate fi atacat de particule electrofilă. Cu toate acestea, în cazul compușilor de aromă-ically urmare a unui astfel de atac ar fi destul de diferite. Stabilitatea ridicată a p-sistem conduce la faptul că la sfârșitul reacției este de obicei redusă, iar rezultatele-că reacția nu se alătură (ceea ce ar distruge
p-sistem) și substituția electrofilă. Luați în considerare detaliile mecanismului său.
În prima etapă a ataca moleculele AB care conțin centru electrofil A, conduce la formarea de p complex extrem de instabilă (etapa 1). Atunci când acest sistem nu este un aromatic Naru-Shen. În plus, legătura covalentă formată de unul dintre atomii țăruș-CTU cu particule A (etapa 2). În acest caz, în primul rând, rupt în legătură A-C, și în al doilea rând, a distrus p-sistem. Molecula rezultată instabil încărcat pozitiv numit s-complex. După cum sa menționat deja, sistemul p-recuperare este energetic foarte favorabil, și duce la o ruptură a C-A (în cazul în care molecula revine la starea inițială) sau C-H (etapa 3). În acest ultim caz, etapa de reacție în sus-INDICA și obținut substituția hidrogenului produs pe A.
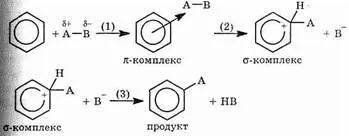
Cele mai multe reacții ale compușilor aromatici au doar un astfel de mecanism (substituție electrofilă, dar cut-SE). Luați în considerare unele dintre ele.
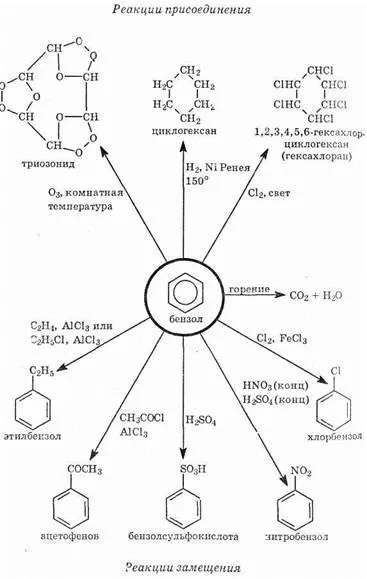
1. Halogenarea. Apare numai în prezența catalizatorilor - Lewis acizi (vezi „Teoria lui Lewis.). mash Sarcina laminate - molecule de polarizare cu halogen, pentru a forma un bun centru electrofil:
| AlCl3 + Cl2 „CI + [AlSl4] - Particula rezultat are un atom de clor electrofilă, și
Prin nitrare. Aceasta a efectuat cu un amestec de acid azotic și lot pis sulfuric (amestec de nitrare). Reacția amestecului de nitrare are loc:
In nitroniu sulfat acid format un puternic electrofilă centru - ion nitronium NO + 2. Prin urmare, reacția are loc, ecuația generală este:
3. Sulfonarea. Acidul sulfuric concentrat este egal-de echilibru:
În molecula de partea dreapta a echilibrului există un puternic electrofil SO3H +. care reacționează cu benzen. Rezultanta-al reacției:
Alchilarea prin acilare Friedel-Crafts. Când reacția dintre benzen cu cloruri de alchil sau alchenelor în prezența unui acid Lewis (de obicei, halogenuri de aluminiu), se obțin benzeni alchil-substituite. În cazul alchil haloaenuri prima etapă a procesului:
RSL AlCl3 + «R + [AlSl4] - În a doua etapă electrofil R atac particule + p-sistem:
În cazul alchenelor de acid Lewis polarizează legătura dublă a alchenei și carbonul se formează din nou centru electrofil:
Prin reacții neelektrofilnym includ:
1. Hidrogenarea benzenului. Această reacție are loc cu sistemul p-distrugere și necesită condiții dure (presiune ridicată, tempera-călătorie, catalizator - platină metalelor):
2. radical de clorurare. In absenta acizilor Lewis si greu ultraviolete razele benzen pot reacționa cu clor cuvă printr-un mecanism radical. Astfel, distrugerea sistemului etsya și aductului p-clor format - solid hexachloran, care a fost utilizat anterior ca insecticid:
Nomenclatura și izomerie Arenes
Toate arena pot fi împărțite în două rânduri. Primul rând - derivați de benzen (toluen, difenil): al doilea rând - (polinucleare) arena condensată-con (naftalină, antracen).
Luați în considerare serii omoloage benzen, această serie de compuși au formula generală CnH2n .6. Izomerii structurali din seria-go omologică benzen datorită substituenților rd aranjament mutual în nucleu. derivați de benzen monosubstituite nu au izomeri de poziție ca toți atomii din nucleul benzenic sunt echivalente,
Grupul I C6 H5 numit fenil. Fenil și grupări fenil substituite sunt numite arii. Mai jos sunt prezentate câteva derivați de benzen:
Reacții benzen Schema
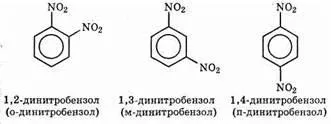
Izomeri cu doi substituenți în poziția 1,2; 1.3 și 1.4 sunt numite orto, izomerii meta și para:
aromatice Nomenclator
Mai jos sunt numele unora aromatice Conn-Neny:
C6 H5 NH3 + CI - clorură de Fenilammony (clorură anilinium)
Acid benzencarboxilic Sa H5 CO2 H (acid benzoic)
C6 H5 CO2 C2 H5 benzencarboxilic ester etilic al acidului (benzoat de etil)
C6 H5 COCI Benzolkarbonilhlorid (benzoil)
C6 H5 CONH2 Benzolkarboksamid (benzamida)
C6 H5 CN benzencarbonitrilul (benzonitril)
C6 H5 CHO Benzolkarbaldegid (benzaldehida)
Aceste nume corespund cu nomenclatura IUPAC. În paranteze sunt denumirile tradiționale, care sunt încă pe scară largă și destul de acceptabile.
Titlu benzen derivat cu două sau mai multe E-substituent în ciclul benzenic este construit în acest mod. atom de carbon al inelului benzenic la care este atașat substituentul, găsindu-schiysya cel mai apropiat de partea superioară a listei de mai sus, primește numărul 1. Apoi, atomii de carbon ai ciclului benzenic sunt numerotate, astfel încât lokant - numărul de al doilea substituent - a fost cel mai mic.
3 Acid gidroksibenzolkarbonovaya (3-gyadroksibenzoynaya acidă)
Gruparea carboxil este văzută ca un artist important, și este numit lokant „1“. Numerotarea inelului este construit astfel încât gruparea hidroxil a avut ( „3“ în loc de „5“) lokant mai mici.
Aminobenzolkarb 2-aldehidă (2-aminobenzaldehidă)
-CHO grup este considerat ca un important. Ea devine lokant "1". Grupul-NH2 este în poziția „2“ în loc de „6“. În plus, este permisă numele-aminobenzaldehidă.
1-brom-2-nitro-4-clorbenzen Aceste grupuri sunt enumerate în ordine alfabetică.
Prepararea hidrocarburilor alifatice. Când catenă dreaptă alcan-pass SRI având cel puțin 6 atomi de carbon pe moleculă peste o platină sau oxi-house crom încălzit (III) are loc dehydrocyclization - formarea cu evoluția Arene hidrogenului. De exemplu:
2. dehidrogenarea cicloalcani. Reacția are loc la aproximativ emisia de vapori-ciclohexan și omologi peste o platină încălzită:
|. benzen Obținerea trimerizare de acetilenă. Cu titlu N. D. Zelinskogo și BA Kazan benzen poate fi preparat prin trecerea prin acetilenă încălzit la 100 ° C, cu tub de cărbune activat. Întregul proces poate fi reprezentat prin schema:
4. Prepararea Omologii de benzen prin Friedel-Crafts (vezi. Proprietățile chimice ale benzenului).
sărurile acizilor aromatici 5. fuziune cu alcali: C6 H6 -COONa + NaOH ®C6 H6 + Na2 CO3
Arena utilizat ca materie primă chimică pentru producerea de produse farmaceutice, materiale plastice, vopsele, pesticide și multe alte substanțe organice. Utilizate pe scară largă ca solvenți arena.
Reacția de dehidrogenare este permisă utilizarea livrărilor de carbohidrați cu ulei pentru un număr de hidrocarburi benzen. Ei ASC de legare pentru a comunica între diferite grupuri de hidrocarburi și la reciprocă transformându-le în reciproc.