molecula de metan - chimist de referință 21
Chimie și Inginerie Chimică
O moleculă de metan lichid care nu conține grupe hidroxil. nu se lipesc împreună. Ele sunt ușor să se disperseze, formarea de gaz. Chiar și la o astfel de temperatură scăzută. ambele -161 C, suficientă căldură pentru a evapora metan - doar temperatura de fierbere -161 C. O molecule de alcool metilic conțin grupări hidroxil. care le face lipicioase. Pentru a le separa unul de altul și transforma într-un gaz, este necesar să-și petreacă o mulțime de energie, cu toate că molecula este doar puțin mai mare decât moleculele de metan. De aceea, punctul de fierbere al metanolului 65 „C - 226 grade mai mare decât cea a metanului [c.86].
Marcatori oferă mari oportunități de a studia în mod direct mecanismul reacțiilor chimice. Ca trasor poate fi aplicat atât izotopi stabili și radioactivi. De obicei, în molecula de test este marcat (t. Atom E este înlocuit cu un izotop radioactiv corespunzător sau stabil) atom specific (cel care suferă de deplasare) și investigate conversia acestuia în reacție. [C.369]
Catena laterală în acest compus este format din atomi de carbon și atașat la acesta trei atomi de hidrogen. Cu alte cuvinte, nu este pur și simplu molecula de metan, fără un atom de hidrogen. O astfel de grupare se numește o grupare metil. un compus format din [c.58]
Să începem cu ceva mai simplu. Imaginați-vă că toți atomii de hidrogen din molecula de atomi de clor metan substituiți [c.68]
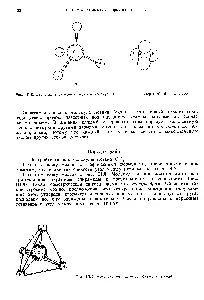
Aceasta determină formarea patru legături C-H și localizarea moleculelor ale atomilor de hidrogen din metan CH4 vârfurile unui tetraedru (Fig. 50). [C.72]
Fig. 121. Formarea Schema de legături în molecula de metan.

Comparați modelul cu Fig. III.8. molecula de metan ar trebui să fie sub formă de piramidă trigonala (cu piramide triunghiulare la partea de jos) (Fig. [C.188]
Fig. III.9. molecula de metan are (yurmu tetraedru.
Tabel. 111,3 sunt, de asemenea, având în vedere numele primilor 10 membri ai seriei alean. Denumirile constau rădăcină nz cu un adaos de închidere. Root indică numărul de atomi de carbon în moleculă. Met - înseamnă un atom de carbon. etaj - două prop - trei, etc. [C.189]
Liantul chimică într-o moleculă de metan. CH4 gestionează bine explicată pe baza reprezentărilor tetraedrice orbitali hr -Hybrid de atomi de carbon. Aceste puncte de vedere, de asemenea, face posibilă pentru a explica structura de etan, MNS. și mulți alți compuși organici. în care atomii de carbon sunt conectate între ele prin legături simple în lanț. Etanului la fiecare dintre doi atomi de carbon, conectate prin trei atomi de hidrogen pentru a forma legături covalente. implicând trei dintre cele patru orbitali hibride hr. A patra oră orbital fiecare atom de carbon este utilizat pentru a forma o legătură covalentă cu un alt atom de aceeași. Suprapunerea p orbitali -Hybrid ale celor doi atomi de carbon dă naștere la o lipire stabilă orbitali moleculare și orbitali antibonding instabile. Lipirea orbital, simetrică față de axa C-C este o umplut orbitală și doi electroni cu spini pereche. [C.565]
Pe baza datelor colectate de clasă definesc căldura molară alean de combustie a unui atom de carbon în moleculă (metan) și opt (octan). [C.206]
Folosind limbajul teoriei obligațiunilor localizate, spunem că molecula de metan CH a avut loc integral în acesta disponibil prin patru echivalent CH legătură unică. Dacă o astfel de reprezentare este corectă, căldura de descompunere a metanului pe atomii de carbon și hidrogen izolate ar trebui să fie de patru ori mai multă energie C-H legătură. (Cu toate că, de fapt, în viitor, entalpia a însemnat peste tot, vom folosi o, deși o terminologie comună, incorectă, și noi presupunem că valorile primite ale energiei de legătură. Mai degrabă decât relațiile de entalpie. Diferența dintre valorile numerice ale entalpiei și energiei legăturile atât de mici încât este în acuratețea abordării, care abordează energia legăturilor localizate.) [C.26]
De asemenea, trebuie remarcat faptul că există o redistribuire a energiei de legare în radicali. Astfel, energia de rupere legăturile în molecula de metan și următorii radicali [c.282]
Software-ul. Menționați cât mai multe dovezi care indică echivalența tuturor conexiunilor din molecula de metan. [C.30]
Am spus deja ca o molecula de metan, fără un atom de hidrogen se numește o grupare metil. Același lucru se aplică la orice hidrocarbură. Etanul fără un atom de hidrogen al grupării etil se numește. In mod similar, au format un grup prolil, Bu-treierat, izobutil și așa mai departe. [C.72]
Cu toate acestea, numele complet ne poate spune ceva este, ceea ce nu se poate spune redus. Din aceasta este clar cum arată molecula. Mai întâi de toate. se termină pe metilmetan - acest lucru înseamnă că ar trebui să înceapă cu molecula de metan și atașată la un grup metil. Triclor înseamnă că trei dintre atomii de hidrogen din molecula trebuie substituit cu clor. Apoi, numele ar trebui să fie. că doi atomi de hidrogen sunt substituiți cu grupare clorfenil, t. e. pe inelul benzenic. în fiecare dintre care îi lipsește un atom de hidrogen și unul dintre atomii de hidrogen substituiți cu clor. Asta e tot. [C.75]
Energeticheskgya molecula orbitali diagrama metan este prezentată în Fig. 45. molecule neexcitat CH4 are două legare și două nivele de energie antibonding. Distribuție opt valență molecule electroni de metan (patru cu patru atomi de carbon și atomii de H-Job) corespunzătoare configurația electronică [c.63]
Molecula se caracterizează printr-un metan relativ ridicat etc. NOSTA. În condiții normale, metan este activ (cu explozie) giruet mazăre cu fluor, clor foarte încet vzaimodeystpuet greu reacționează cu brom. Reacția cu clor sau brom ryaetsya exprima verificare sub lumină. și când pagrevanni și constă în înlocuirea secvențială a atomilor de hidrogen cu atomi de halogen, de formă arbitrară cu halogen, de exemplu [c.467]
Arderea metan va produce compus al acestuia cu oxigenul în formarea de noi produse. Este oxigen, metan se combină cu carbon. dioxid de carbon sub formă și compus cu hidrogen da apă. Astfel, pentru o singură ardere a moleculelor de metan necesită două sau patru molecule de un atom de oxigen, și anume, pentru a transforma carbonul în CO2 nevoie odpa molecula de oxigen. și pentru conversia patru Atemov hidrogen în H2O este necesară, de asemenea, o moleculă de oxigen. un total de patru atomi de oxigen. Pentru mai formula de calcul utilizat Thornton [c.68]
Deasupra am prezentat conceptele tradiționale de hibridizare chimice cuantice a orbitali atomici la exemplele convenționale (CO2, HC CH, H2C == CH2, CH4, SAS, și așa mai departe. D.). Cu toate acestea, aceste idei, care poate fi numit pe bună dreptate un clasic, în unele cazuri, nu sunt aplicabile. Unul dintre astfel de cazuri este de 1 moleculă, b-dikarba- / strat-Zo geksaborana (Fig. 36), unde patru carbon valență AO suficient pentru a construi cinci GAO ortogonale. Cu toate acestea, în cazul defectării cerinței ortogonalitate, așa cum se arată S. G. Semenovym, posibil de a construi un liniar dependente legături set-neorto SYH-diagonală sunt transformați unul în altul prin operațiile de simetrie Ots1- Aceste 15 SYH (6 două centre, localizate la MV sau HV 8 trei centre sunt localizate pe legăturile și un chetyrehtsentrovaya CSAs, identice canonice 2r-1 M0 atomi imbratisand bor) cu occupancies electronice 2 nu poate fi tradus într-o transformare unitară canonică sursă MO 13 (a se compara cu cazul discutat mai sus molecula de metan). [C.216]
Metan, CH4, este echivalent cu patru atomi de hidrogen. atașat la atomul de carbon central. Pentru compușii cu patru atomi de hidrogen la carbon necesar să se utilizeze toate orbitali sale de valență. Prin hibridizare unul 2s și trei 2p orbitali poate primi patru echivalent 5p -Hybrid orbital (Fig. 13-5). Fiecare 5p -zu bridnaya-orbital are un sfert din 5 caractere și a trei sferturi din caracterul district. Toate cele patru creasta orbitale îndreptate spre colțurile unui tetraedru regulat. astfel încât creasta orbital este numit uneori hibrizi tetraedrice. Ca rezultat, se suprapun fiecare oră -Hybrid cu 1x orbita de hidrogen orbital format patru orbitali de unire localizate. Nailuchschee suprapunere între orbitalii și 1x este obținută prin plasarea celor patru atomi de hidrogen în vârfurile unui tetraedru regulat. așa cum se arată în Fig. 13-6 (care prezintă un cub, care vârfuri de formă alternante denumite nodurile tetraedru). Metanul molecula opt electroni de valență (patru atomi de carbon și unul din fiecare din cei patru atomi de hidrogen), care trebuie [c.555]
Să considerăm ca exemplu canonici MO moleculele de metan CH4 (simmetryya Ta), în apropierea MO LCAO (Fig. 35) [c.206]