Măsurarea activității enzimei
Conceptul de enzime
Enzime (enzime) numite proteine solubile sau legate de membrană înzestrate cu activitate catalitică. (Cu excepția proteinelor activității catalitice în organism poate prezenta unele ARN (ribozomi) și anticorpi (abzime), dar acestea sunt mai puțin eficiente în mii de ori, decât enzimele.) Aceste nume provine din latinescul «fermente» - fermentare și greacă «en ZYM» - în cadrul ferment. Ele amintesc de primele surse de enzime. Biochimie care studiaza enzime numite enzimologie. Diagrame și ecuații ale reacțiilor de enzime din molecula sunt - E. Substanțele care catalizează conversia enzimelor numite substraturile (S). Produse de reaktsiioboznachayut enzimatice - P. Deoarece enzimele sunt proteine, acestea sunt obținute într-o formă omogenă, în același fel ca alte proteine. Pentru enzime proprietăți caracteristice fizico-chimice inerente proteinelor.
Spre deosebire de enzimele din catalizatori anorganici:
a) accelera reacția este mult mai eficient;
b) sunt înzestrați cu o înaltă specificitate de acțiune;
c) supuse reglementării în condiții fiziologice;
g) funcționează în condiții blânde.
Enzimele pot fi atât proteine simple și complexe (conjugate), care pot include lipide, carbohidrați, ioni metalici, baze azotate, derivați de vitamine. In corpul uman poate funcționa ca enzime în stare solubilă, cât și sub formă de complexe insolubile sau să facă parte din membranele biologice.
Caracteristica distinctivă este prezența situsului activ enzime. Activ centru - o combinație unică de resturi de aminoacizi adiacente din spațiu, care prevede:
a) molecula de recunoaștere substrat,
b) legarea substratului la enzimă,
c) efectuarea de transformări catalitice (în cazul unui complex act enzimatic cataliză ca coenzimă ia parte, o parte a centrului activ).
Site activ apare la un moment în care proteina falduri și adoptă nativă conformație (activă). Structura site-ului activ poate fi modificat prin reacția cu substrat. În expresie figurativă substrat D. Koshland potrivit pentru centrul activ al mâinii pentru mănuși.
O molecula de enzimă, în special în cazul în care este format din mai multe subunități pot conține mai mult de un sit activ.
În centrul activ are două secțiuni. Prima porțiune este responsabilă pentru recunoașterea substratului și de legare. Se numește site-legare substrat, sau un tampon ancoră. A doua secțiune se numește un catalizator, acesta este compus din resturi de aminoacizi implicate în actul cataliză.
Enzimele sunt proteine care diferă foarte mult în greutate moleculară și complexitatea structurală. Un exemplu de enzimă mică moleculă cu ribonucleazei este compus dintr-o subunitate unică de greutate moleculară 13.700 Da. (U secvență de aminoacizi ribonucleazei definit. In 1969, ribonucleaza a fost sintetizat în laborator B.Merrifilda din New York.) Multe enzime sunt compuse din mai multe subunități, cum ar fi lactat dehidrogenazei este format din patru subunități a două tipuri. Sunt cunoscute în prezent unele complexe Multienzyme formate din zeci de diferite tipuri de subunități și mai multe coenzime. De exemplu, complexul piruvat dehidrogenază este format din 60 subunități ale celor trei tipuri și cinci tipuri de cofactori. Greutatea moleculară a acestui complex este de 2,3 * 6-10 octombrie * 10 iunie da în funcție de sursa enzimei. Molecula de enzimă poate fi mai mică decât molecula de substrat. De exemplu: moleculele amilazei și ribonucleazei enzime mai puțin decât molecula de substratul lor - amidon și ARN.
Complexul proteic al enzimei este inactiv catalitic și se numește apoenzimei. Legarea apoenzimei cu componenta nonproteinici conduce la formarea unei enzime active catalitic (holoenzimă):
Multe enzime conțin în structura ionului metalic, care poate efectua o varietate de funcții:
a) participă la legarea substratului și a procesului de conversie catalitică;
b) să promoveze aderarea la coenzimei a moleculei de enzimă;
c) stabilizarea structurii terțiare a enzimei (de exemplu, Ca2 + în amilaza);
d) punerea în contact a substratului pentru a forma un substrat adevărat pe care acționează enzima.
Mulți coenzime sunt derivați de vitamine, prin urmare, un deficit metabolic tulburare de vitamina datorită scăderii activității anumitor enzime.
Unele enzime în plus față de centrul activ conține un Centru (reglementare) allosteric - un situs al Globula de proteine, in afara site-ul activ, care se poate lega de substanțele care reglementează activitatea enzimatică. Aceste substanțe sunt numite efectori alosterici (activatori alosterici sau inhibitori). Ca rezultat al legării la un centru de efector alosteric schimbă structura proteinei, ceea ce duce la o schimbare în dispunerea spațială a resturilor de aminoacizi din centrul activ și, în cele din urmă, pentru a schimba activitatea enzimei.
Enzime gasite într-un singur organism și catalizează aceeași reacție chimică, dar cu diferite structuri primare a proteinei, numita izoenzime. Izoenzime diferă unul de altul prin astfel de proprietăți fizico-chimice ca greutatea moleculară, stabilitatea termică, specificitatea de substrat, mobilitatea electroforetică. Natura apariția izoenzime a variat, dar cel mai adesea cauzate de diferențele în structura genelor care codifică aceste izoenzime sau subunitate. De exemplu, dehidrogenaza (LDH), catalizează reacția reversibilă a oxidării lactat piruvatului are patru subunități a două tipuri de M și N, combinația dintre subunitățile formează baza formării cinci izoenzime LDH (Fig.1). Pentru diagnosticul de inima si boli de ficat au nevoie pentru a studia spectru izoenzimă de LDH ser LDG1 și LDG2 activă în mușchiul cardiac și rinichii, și LDG4 și LDG5 - și musculaturii scheletice și ficatului.
Fig.1 Structura diferitelor izoenzime ale LDH.
Măsurarea activității enzimei
Determinarea activității enzimei se realizează prin măsurarea reacțiilor de viteză catalizate. Viteza reacției enzimatice este măsurată prin descreșterea sau creșterea concentrației substratului produs de concentrație per unitate de timp:
unde # 916; Cs - schimbarea concentrației substratului molar (mol / l)
# 916; CP - schimbarea concentrația molară a produsului de reacție (mol / l)
# 916; # 964; - cu o schimbare de timp (minute, secunde).
Studiile cinetice, de preferință, efectuată la saturarea concentrația de substrat, altfel enzima nu va fi în măsură să demonstreze activitate maximă.
Unități de activitate enzimatică:
enzimă unitate internațională (U) - este o cantitate de enzimă care catalizează conversia 1 micromol de substrat în 1 minut la 25 ° C și pH-ul optim.
Unitatea SI de enzimă este katal (kat) este acea cantitate de enzimă care catalizează conversia unuia molsubstrata timp de 1 secundă. Este ușor de calculat că:
1 U = (1 * 10 -6 M) / 60 = 1,67 * 10 -8 M-1 = 1, 67 * 10 -8 Cat = 16,7 nkat.
adesea determină activitatea specifică a preparatelor din activitatea enzimei prin divizarea preparatul enzimatic probei, exprimată ca (U), față de greutatea probei în miligrame:
U = AUD / masa de medicament (mg)
Când curățarea enzime crește specifice de activitate. Prin creșterea activității specifice poate fi evaluată pe baza eficienței purificării și puritatea etapelor de preparare a enzimei.
Pentru a evalua activitatea preparatelor înalt purificate, omogene de enzime care separă numărul de unități internaționale (U) a enzimei în proba cantității de substanță enzimatică (pmol) din probă se calculează activitatea molară (numărul de rotații). Fizic, activitatea molară - este numărul de molecule de substrat care sunt convertite la o moleculă de enzimă per 1 minut sau 1 secundă. De exemplu: pentru accelerarea ureazei hidroliza ureei, activitatea molară este 30000, tripsina - 102, glucoză oxidazei - 17.000 cicluri pe secundă.
4.1. Mecanismul de acțiune. Enzime nu deplasează reacția de echilibru catalizat spre formarea produșilor, astfel, echilibrul de reacție constantă rămâne constantă. La fel ca toți catalizatorii, enzimele sunt reduc doar timpul pentru a atinge acest echilibru. In cele mai multe cazuri, enzimele accelera reacția la 10 din perioada 7 - 10 14 ori. Baza eficienței cataliză enzimatică este o scădere puternică a energiei de activare a reacției prin transformarea substratului in produs prin stări de tranziție.
4.2. Specificitatea acțiunii. Specificitatea de legare a substratului și traseul de curgere determinat de apoenzimei reacția enzimatică. Specificitatea activității enzimatice direcționate determină metabolismul organismului.
Despre Enzimele spun că au o specificitate de substrat îngust. în cazul în care acestea operează pe o gamă foarte mică de substraturi. Uneori este posibil să vorbim despre specificitatea de substrat absolut, de exemplu, catalaza catalizează doar o singură reacție - descompunerea peroxidului de hidrogen:
Pentru cele mai multe enzime sunt caracterizate prin relativa (grupul larg) specificitatea de substrat. când cataliza un grup de reacții similare. De exemplu, alcool dehidrogenaza catalizează conversia alcoolilor la aldehide, în care ca substraturi pot acționa ca metanol, etanol, propanol și alți alcooli. De interes este faptul că alcool dehidrogenază pot oxida și alcooli nelineare, și un grup de alcool, care face parte din molecule complexe, în special, această enzimă poate cataliza conversia retinolului în retinal. Firește, enzime înzestrați cu o specificitate de substrat larg, catalizează transformarea substraturilor cu randamente diferite.
Enzimele sunt, de asemenea, dotate cu specificitate stereochimică. site-ul lor activ al moleculei recunoaște substraturi ale configurației spațiale. De exemplu, L-amino-oxidazei acidului activ împotriva acizilor numai L-amino și absolut nici un efect asupra D-analogii lor. Pentru dezaminarea oxidativă a D-aminoacizi din organismele vii sunt oxidaza acidul D-amino, nu acționează asupra L-amino acizi. Este centrul activ al capacității de a se lega la anumiți stereoizomeri ai substratului stă la baza funcționării enzimelor, cum ar fi racemaza care un stereoizomer este convertit intr-o alta.
căi de conversie Specificitatea este că un substrat sub acțiunea diferitelor enzime pot fi convertite în produse care diferă în structură și rol în metabolismul.
Iată un exemplu: L-acid amino-oxidaza acționează asupra L-aminoacizi, transformându-le în acidul alfa-ceto cu formarea de amoniac si peroxid de hidrogen.
L-amino decarboxilaza acidului se leagă la aceleași substraturi, dar cataliza reacție diferită: decarboxilarea cu formarea de amine biogene și eliberarea de dioxid de carbon.
Un alt exemplu este posibilitatea de conversie a glucozei 6-fosfat prin acțiunea diferitelor enzime, una dintre posibilele căi:
Ca multe alte proteine, enzime la temperaturi mai mari suferă Denaturarea termică, care perturbă conformația nativă a enzimei și modificarea structurii site-ului activ. enzime mamifere încep să denature apreciabil la temperaturi de peste 40 ° C
În legătură cu preparatele enzimatice mai sus stocate, de preferință, la temperaturi mai scăzute. Unul dintre cel mai bun mod de a conserva enzimele lor este liofilizarea (uscarea la o temperatură sub -70 ° C în vid) a fost tradus într-o stare parțial denaturat folosind săruri de amoniu și plasarea într-un frigider.
4.4. Dependența vitezei de reacție la temperatură. Rata reacțiilor enzimatice, orice reacții chimice depinde de temperatură. Pe măsură ce temperatura crește cu 10 ° C, viteza de reacție este crescută de 2-4 ori conform unei reguli van't Hoff. Cu toate acestea, la temperaturi de peste 40 ° C devine Denaturarea substanțială a enzimelor, care reduce activitatea totală (Figura 2) .:
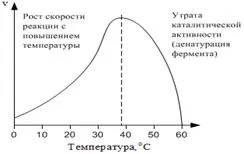
Fig. 2. Dependența de temperatură a vitezei de reacție enzimatică.
4.5. Dependența vitezei de reacție la pH. Dependența ratei reacției enzimatice pH-ul are o formă în formă de clopot (fig. 3). PH-ul la care cea mai mare rată observată de reacții enzimatice este numită optim (pH optim). Natura curbelor și pH optim depinde de natura substratului și grupările încărcate ale grupărilor încărcate ale enzimei (în special cele în situsul activ). PH-ul optim pentru majoritatea enzimelor se află în intervalul 6.0-8.0 (Fig. 3).
Fig. 3. Dependența vitezei de reacție enzimatică de pH.
Cu toate acestea, există excepții, de exemplu, pepsina este cel mai activ la pH 1,5 - 2,0, și fosfataza alcalină la pH 10.0-10.5 (Figura 4).
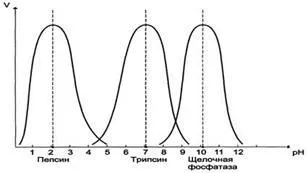
Fig. 4. Dependența vitezei de reacție enzimatică (v) pH-ul mediului.
In extreme (foarte scăzut sau foarte ridicat) încălcarea are loc pH structura terțiară a moleculei enzimei, rezultând în pierderea activității enzimatice.