Limita de proprietate de acid carboxilic
Acizii carboxilici conțin gruparea carboxil -COOH. proprietăți acide sunt determinate de natura radicalului R, de obicei, un acid slab, pH = 4-5. Numele este derivat din hidrocarbura corespunzătoare cu adăugare de închidere „acidului -vaya“ sau închidere „ester benzilic al acidului“ la hidrocarburi per atom mai puțin:
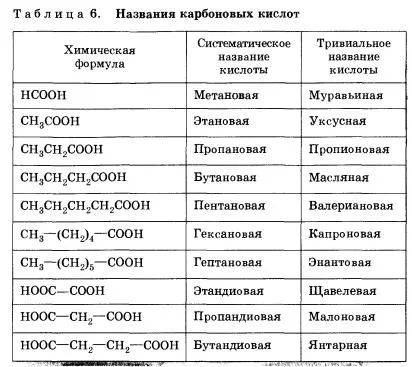
R = H - acidul metan, acid formic;
R = CH3 - acidul etanoic, acidul metankarbonovaya, acidul acetic;
R = C 2H 5 - propanoic, acid etankarbonovaya, acid propionic;
R = C 6H 5 - acid benzoic, acid carboxilic fenil;
R = (C 6H 5) 3C - trifenil acid acetic.
1. Disocierea pentru a forma cationii de hidrogen și anioni ai unui rest de acid. Mai precis, acest procedeu este descris de o ecuație, luând în considerare participarea a moleculelor de apă.
carboxilic echilibru de disociere acidă este deplasată spre stânga, marea majoritate a acestora - electroliții slabi. Este evident că prezența în moleculele acizilor carboxilici „acide“ hidrogen, t. E. Hidrogenul grupării carboxil datorită altor proprietăți caracteristice.
2. Interacțiunea cu metale. în picioare în seria de tensiune electrochimică a hidrogenului. Astfel, fierul recuperează hidrogen din acid acetic:
2CH3-COOH + Fe -> (CHgCOO) 2Fe + H2
3. Interacțiunea cu oxizii de bază pentru a forma sare și apă:
2R-COOH + CaO -> (R-COO) 2Ca + H20
4. Interacțiunea cu hidroxizi metalici pentru a forma săruri și apă (reacție de neutralizare):
R-COOH + NaOH -> R-COONa + H20 3R-COOH + Ca (OH) 2 -> (R-COO) 2Ca + 2H20
5. Interacțiunea cu săruri ale acizilor slabi. cu formarea acesteia. De exemplu, acidul acetic, stearic dislocă de stearat de sodiu și carbonat de potasiu de cărbune.
6. reacția acizilor carboxilici cu alcooli, pentru a forma esteri - ai cunoscut deja reacția ete-rifikatsii (una dintre cele mai importante reacții caracteristice pentru acizii carboxilici). Reacția acizilor carboxilici cu alcooli catalizate de cationi de hidrogen.
Reacția de esterificare este reversibilă. Equilibrium deplasează spre formarea esterului în prezența vodootni-cerned cu instrumente și îndepărtarea eterului din amestecul de reacție.
Reacția inversă a esterificare, care este numit prin hidroliza esterului (reacția cu apă a esterului), acid și alcool se formează. Este evident că reacționează cu acizi carboxilici, adică intră în reacția de esterificare poate și alcooli polihidrici, cum ar fi glicerol ..:
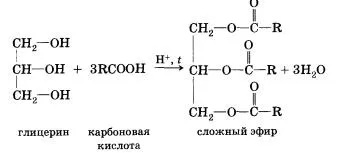
Acid carboxilic DCE (cu excepția formic), împreună cu o grupare carboxil conținută în moleculele reziduului de hidrocarburi. Desigur, acest lucru nu poate afecta proprietățile acizilor, care sunt determinate de natura reziduului de hidrocarbură.
7. Reacțiile de atașament la dubla legătură - provin acid carboxilic nesaturat; de exemplu, -gidrirovanie reacție de adiție de hidrogen. Hidrogenarea acid oleic, acid stearic format o limită.
acid carboxilic nesaturat ca și alți compuși nesaturați, halogeni atașat la dubla legătură. Astfel, de exemplu, acid acrilic decolorează apă de brom.
8. reacții de substituție (halogen) - în ea se poate alătura acidul carboxilic marginal; de exemplu, prin reacția acidului acetic cu clor pot fi preparate prin diverse de acid clorurat:
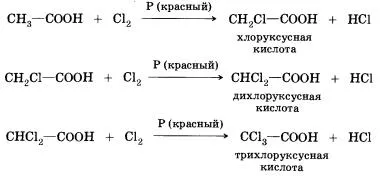
Atunci când halogenarea acizilor carboxilici care conțin un atom de mai mult de un carbon în restul hidrocarbonat pot forma produse cu diferite poziții ale halogenului în moleculă. Când reacția are loc printr-un mecanism de radicali liberi poate fi substituit cu oricare dintre atomii de hidrogen într-un rest de hidrocarbură. Dacă reacția este condusă în prezența unor mici cantități de fosfor roșu, este selectiv - numai hidrogen este substituit în poziția alfa (cea mai apropiată de gruparea funcțională de atomi de carbon), în molecula de acid. Motivele pentru această selectivitate, veți învăța în studiul chimiei la universitate.
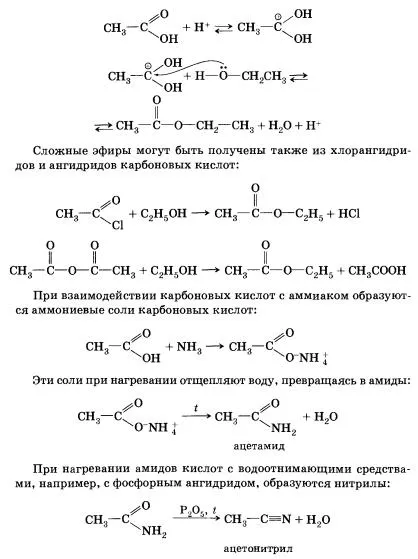
Acizii carboxilici formează diferiți derivați funcționali prin substituirea grupării hidroxil. Hidroliza acestor derivați sunt nou formate acid carboxilic.
clorură de acid carboxilic poate fi obținut la acțiunea clorurii acide, fosfor (III) sau clorură de tionil (SOSl2). Anhidridele acizilor carboxilici sunt preparați prin reacția unui clor-anhidride cu săruri ale acizilor carboxilici. Esteri format prin esterificarea acizilor carboxilici cu alcooli. Esterificarea este catalizată de acizi minerali.
Această reacție se va iniția protonarea grupării carboxil - reacționând cation hidrogen (proton) din perechea de electroni unshared atomului de oxigen. Protonarea grupării carboxil determină o creștere a sarcinii pozitive asupra atomului de carbon din ea:
Dacă numărul de atomi de carbon în catena nu depășește cinci, ea brusc miros, lichid mobil și volatile. Deasupra cinci - grele, substanțe uleioase, mai mult - tare, ceros.
Densitatea primilor doi membri este mai mare decât unu. Toate celelalte mai ușoare decât apa.
Punct de fierbere: cu cât lanțul, cu atât mai mare scor. Structura mai ramificată, așa mai jos.
Punct de topire: depinde de paritatea numărului de atomi de carbon în catenă. Y este chiar mai mare în impar de mai jos.
În apă, se dizolvă foarte bine.
Sunt capabile să formeze legături de hidrogen puternice