Lab 7
Reacții de culoare pentru proteine
Experiența de reacție 1.Biuretovaya.
reacție Biuretul - calitate pentru toți, fără excepție proteine. și produsele de hidroliză parțială a acestora. care conțin cel puțin două legături peptidice.
Principiul metodei. reacția de biuret datorită prezenței legăturilor peptidice în proteine (- CO - NH -), care, într-un mediu alcalin pentru a forma un sulfat de cupru (II), vopsite în complexe de sare cum ar fi culoarea de cupru roșu-violet. reacția biuret oferă unele substanțe neproteice, cum ar fi biuret (NH2-CO-NH-CO-NH2), oxamidă (NH2 CO-CO-NH2), un număr de aminoacizi (histidină. Serina. treonină. asparagină).
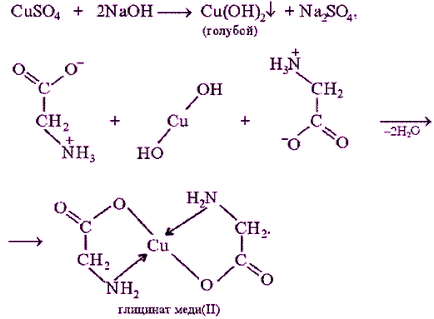
reacția biuret cu glicină
Ordinea de performanță.
La 1 ml de soluție de proteină de 1% a fost adăugat un volum egal de soluție de hidroxid de sodiu 10% (NaOH) alcalin și apoi 2-3 picături de soluție 1% de sulfat de cupru (CuSO4). dilua, soluție aproape incoloră de sulfat de cupru.
Când o reacție pozitivă apare de culoare violet, cu o tentă roșie sau albastră.
Experiența 2.Reaktsiyana „slab cuplate sulf.“
Principiul metodei. Aceasta este o reacție la cisteina și cistina. Hidroliza alcalină „sulf slab cuplate“ în cisteină și cistină destul de ușor scindate, formând astfel hidrogen sulfurat, care reacționează cu alcalii dă sodiu sau potasiu sulfurat. Prin adăugarea de acetat de plumb (II) format precipitat de sulfură de plumb (II) un gri-negru.
Ordinea de performanță.
Tubul se toarnă 1 ml proteină de pui nediluat se adaugă 2 ml de soluție de hidroxid de sodiu 20%. Amestecul a fost încălzit ușor (la amestec este aruncat).
Aceasta eliberează amoniac, care este detectată de hârtie de turnesol umed albăstreală pentru rufe, badged la deschiderea tuburilor (nu atinge peretii). Precipitatul rezultat este dizolvat cu reflux ușor și apoi se adaugă 0,5 ml dintr-o soluție de acetat de plumb (II). Există o pierdere de gri-negru precipitat plumb sulfură (II):
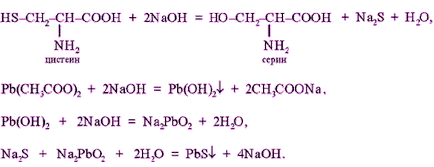
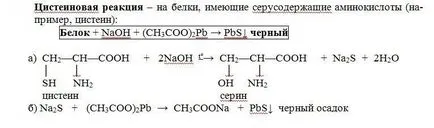
Țeava de turnare 1 ml. proteine de pui nediluat se adaugă 2 ml. soluție alcalină concentrată, pune mai multe refierbătoare. La soluția fierbinte s-a adăugat o soluție de plumbite de sodiu - format o culoare galben-maro sau negru. (Sodiu Plyumbit preparat după cum urmează: a 1 ml de soluție de acetat de plumb alcalină s-a adăugat în picături până la dizolvare care formează inițial un precipitat de hidroxid de plumb).
În prezența aminoacizilor sulfului acizilor din molecula de proteină (cistină, cisteină) a acestor aminoacizi este clivat treptat sulf sub forma unui ion în starea de oxidare - 2, a cărei prezență este detectată și ion de plumb, ion de sulf care formează sulfura de plumb insolubil, negru:
Pb (CH3 COO) 2 + 2NaOH Pb (OH) 2 + 2 CH3 COONa,
Pb (OH) 2 + 2NaOH + Na2 PbO2 H2O,
Na2S + Na2 PbO2 + 2H2O PbS + 4NaOH.
A face experiența: pentru a trage o concluzie și scrie ecuația reacției.
3. Experiența ksantoproteinovaya proteine de raspuns.
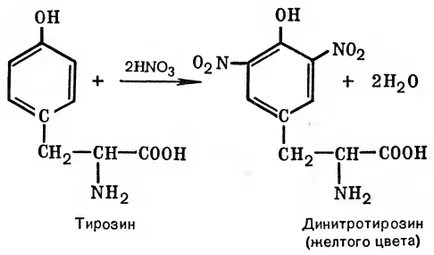
Principiul metodei. Această reacție este utilizată pentru detectarea unui-aminoacizi care conțin radicali aromatici. Tirozină, triptofan, fenilalanină prin reacția cu acid azotic concentrat, pentru a forma nitro derivați având o colorație galbenă. Într-un mediu alcalin, acești derivați nitro ai-aminoacizilor da săruri, vopsite în culoarea portocalie. Gelatina, de exemplu, nu conține aminoacizi aromatici, nu proba ksantoproteinovaya.
Ordinea de performanță.
La 1 ml de 10% ou se adaugă 0,5 ml de soluție concentrată de proteină de acid azotic. Ca rezultat, coagularea proteinelor, un precipitat alb sau turbiditate în conținutul tubului. După încălzirea soluției și precipitatul este colorat într-o culoare galben strălucitor. In acest precipitat aproape complet dizolvat în hidroliză. După răcire, 2,1 ml de soluție de hidroxid de sodiu 20% (până când culoarea portocalie a soluției).
Să luăm în considerare mecanismul reacției de tirozină ksantoproteinovaya radicală:
Să luăm în considerare mecanismul reacției de tirozină ksantoproteinovaya radicală:
Produs de condensare albastru-violet
Reacția cu ninhidrină este utilizat pentru detectarea vizuală a-aminoacizi în cromatograma (hârtie, în strat subțire), și, de asemenea, pentru determinarea colorimetrică a concentrației de aminoacizi din intensitatea colorației produsului de reacție.
Produsul din această reacție conține în componența sa un radical (R) al aminoacidului inițial, care determină diferite culori: albastru, roșu, etc. Compușii care rezultă din reacțiile de aminoacizi cu ninhidrină.
În prezent, reacția ninhidrină este larg utilizat pentru deschiderea de aminoacizi individuali, și pentru a determina valoarea lor.
Ordinea de performanță.
Țeava de turnare 1 ml de soluție diluată de tărie 1,10% din ou de pui alb, și 2,1 ml dintr-o soluție 1% de ninhidrină în acetonă. Conținutul tubului de testare și se agită timp de 2-3 minute încălzite ușor într-o baie de apă până când culoarea albastru-violet, indicând prezența a-aminoacizi în proteină.
A face experiența: pentru a trage o concluzie și scrie ecuația reacției.
Experimentul 2. Sărare de clorură de sodiu și proteine sulfat de magneziu.
Principiul metodei. Pentru sărare din proteine din soluție se aplică de clorură de sodiu, sulfat de sodiu, acetat de sodiu, sulfat de magneziu, acetat de potasiu, clorură de calciu, azotat de calciu și sulfat de amoniu. Unele dintre săruri nu numai proteine sărați cu saturarea soluției; anumite proteine și sărare în săruri, la concentrații suficient de scăzute. Astfel de săruri includ sulfat de amoniu. Condițiile în care precipitarea cu sulfat de amoniu, tipică pentru proteinele individuale (cu rare excepții) că această proprietate de proteine pot fi comparate cu solubilitatea caracterizează substanța cristalină.
Proteinele sunt compuse din aminoacizi și, prin urmare, au proprietăți amfoteri. Atunci când se dizolvă în apă de ioni de proteine de hidrogen, care rezultă din disocierea grupării carboxil este atașată la o grupare amino. Prin urmare, moleculele de proteine suportă cheltuieli atât pozitive, cât și negative. Cantitatea de încărcare determinată de numărul de grupări ionice. La un anumit pH sarcina electrică totală a moleculelor de proteine este egal cu zero. O astfel de valoare a pH se numește punctul izoelectric (Pj). Punctul izoelectric al soluțiilor de proteine au o stabilitate minimă, deoarece le lipsește principalul factor de stabilizare - taxa și, prin urmare, ușor de precipitat. Se determină punctul de proteine izoelectric poate, determinarea pH-ului la care soluția de proteină este mai neclară. Cele mai multe proteine punctul izoelectric se află într-un mediu slab acid.
Precipitarea proteinelor NaCl și MgSO4 - clorură de sodiu și sulfat de magneziu, în contrast cu sulfat de amoniu precipită globulinelor din soluție saturată. Punctul izoelectric al acelorași săruri globulinele sunt precipitate la o concentrație scăzută.
Ordinea de performanță.
Cele două tuburi au fost turnate, se adaugă, sub agitare, până la saturație completă (când cristalele rămân nerastvoronnoy în ciuda agitației) într-un tub de clorură de sodiu fin măcinată, într-un alt 5 ml de soluție de proteină 1% - sulfat de magneziu. Câteva minute mai târziu, cele două tuburi există un depozit de globuline. Precipitarea a fost filtrat și la filtrat se adaugă câteva picături de acid acetic diluat (CH3COOH) - într-un mediu slab acid cade albuminele. soluție de albumină ca pH-ul se apropie de punctul izoelectric.
Soluția apoasă de particule proteice sunt încărcate și foarte hidratat, ceea ce conduce la stabilitatea soluțiilor de proteine. Cu toate acestea, la concentrație mare de săruri, ioni, care sunt, de asemenea, membrane foarte hidratate sunt distruse molecule proteice apoase și de încărcare este îndepărtat din molecula de proteină adsorbită pe acesta ioni de sare.
Ca rezultat al acestor două procese devin soluții proteice instabile, particule proteice se coaguleze una cu alta, devin mai mari și în final precipită.
A face experiența: rezultatele experienței scrise în notebook-uri și să tragă o concluzie.
Experimentul 3. Proteinele de coagulare sub încălzire.
Principiul metodei. Pierderea de proteine din precipitat prin încălzire caracteristic pentru aproape toate proteinele (cu excepția gelatină, nu coagula atunci când este încălzit). O precipitare deosebit de ușoară și mai completă a proteinei are loc într-un mediu slab acid în vecinătatea punctului izoelectric. În medii neutre și puternic acide, există o precipitare a proteinelor este mult mai rău, și într-un mediu alcalin, nu se observă.
Mediul alcalin este redus de disociere a radicalilor proteină diamino, moleculele sale dobândesc sarcină negativă, astfel încât să rămână în soluție, chiar atunci când sunt încălzite până la fierbere.
Adăugarea la soluția de proteină de sare neutră (NaCl) facilitează și accelerează coagularea proteinelor la fierbere, care vin particule proteice datorate deshidratante.
Ordinea de performanță.
In 5 tuburi se toarnă la 2 ml. proteină: primul tub este încălzit, și apare precipitatul înainte de a fierbe lichidul. Pentru al doilea tub s-a adăugat 1 picătură de soluție 1% de acid acetic (CH3COOH) și încălzit. proteina floconos precipită rapid și mai complet decât în tubul primul test, datorită faptului că acidifierea pH-ul soluției în apropierea punctului izoelectric al proteinei (proteină e = 0). Într-un al treilea flacon s-a adăugat 0,5 ml. 10% acid acetic (CH3COOH) și încălzit. Precipitatul nu se formează chiar după fierbere. În al patrulea tub s-a adăugat 0,5 ml. 10% acid acetic (CH3COOH) și câteva picături de soluție de clorură de sodiu saturată și se încălzește. Peletul este. Al cincilea tub s-a adăugat 0,5 ml. soluție caustică 10% și se încălzește. Precipitatul nu este format chiar și atunci când fierte. Efectuarea de lucru.
Rezultatele testelor și concluziile sunt înregistrate în tabel.
Experiența 5. Depunerile de proteine concentrate de acizi minerali.
Principiul metodei. Acizii minerali concentrați provoca precipitarea proteinelor ireversibile. Acest lucru se datorează deshidratarea moleculelor proteice sau Denaturarea proteinei din.
Acizii minerali concentrați provoca denaturarea proteinei prin îndepărtarea stabilității factorii de proteine în soluție (încărcare și coajă de hidratare) pentru a forma o proteină de săruri complexe cu acizi. Acid ortofosfat nu precipită.
În plus față de acizi minerali, cu excepția nitric precipitat proteic peletă a fost dizolvată. Probabil, acest lucru are loc ca rezultat al realimentarea moleculelor de proteină și hidroliza parțială a acestora.
Prin adăugarea unui exces de acid azotic are loc dizolvarea cake. De aceea, pentru determinarea unor cantități mici de proteine în urină, în studiile clinice au utilizat acid azotic (metoda Roberts - Stolnikova - Brendberga).
Ordinea de performanță.
Tubul 3 este turnat în 1 ml. Acizii minerali: azotic, sulfuric și clorhidric. Apoi pipetată încet de-a lungul peretelui tuburilor se toarnă 0,5 ml. soluție de proteină, astfel încât nu este amestecat cu un acid. La punctul de contact al celor două lichide apare ca un alb precipitat proteic amorf.
Cu agitare într-un tub de testare cu azot crește precipitat de acid, celelalte două tuburi precipitatul a fost dizolvat într-un exces de acid.
A face experiența: rezultatele experienței scrise în notebook-uri și să tragă o concluzie.
Experiența 7. Precipitarea proteinelor alcool
Principiul metodei. proteină prelungită în contact cu alcoolul duce la precipitarea ireversibilă, Denaturarea, rezultat fulgilor de proteine precipitat scade datorită deshidratării moleculelor proteice în timp ce adăugarea de alcool.
Sub înțeleagă conformație denaturare tridimensională a pierderii inerente moleculei de proteină. Această schimbare poate fi temporară sau permanentă, dar, de fapt, și într-un alt caz, secvența de aminoacizi a proteinei rămâne neschimbată. molecula Denaturarea se desfasoara si isi pierde capacitatea sa de a îndeplini funcția sa normală biologică.
proteină de reacție de precipitare cu alcool sau alcool efect tranzitoriu este reversibil la răcire. În cazul în care depozitul separat rapid de alcool, proteina poate păstra starea nativă.
Ordinea de performanță.
Țeava de turnare 1 ml. soluție de proteină s-a adăugat un pic de clorură de sodiu cristalină, se toarnă treptat la 3-4 ml. alcool etilic.