Kachanovskii e
II) Supliment la lucrarea de laborator № 9 „Reacția Belousov -. Zhabotinsky“ Reacțiile lot calitative.
III) Activitatea optică a moleculelor biologice.
IV) Determinarea cantitativă a proteinei în soluție.
L A B O R A T O R I A N P A B S T A №1
Izolarea ADN-ului.
Obiectiv: Pentru a explora principiile de bază și tehnicile practice pentru izolarea și purificarea ADN-ului din țesuturi animale și vegetale.
D B e n e
Partea teoretică a lucrării este preluată din succesele biologiei moderne VOLUMUL 91 (1981), voi. 1, p.49 - 59 / CURENTE METODE ului din PLANTE SUPERIOARE Miroshnychenko GP Dyachenko L. F.
Până în prezent, avem destul de un set mare de metode de extracție și purificare a ADN-ului de plante, iar aceste metode continuă să evolueze și să fie modificate în raport cu obiecte noi de cercetare. Utilizarea unei metode de izolare ADN este dictată, în primul rând, specificitatea materialului în studiu, și în al doilea rând, cele care au drept scop: obținerea totală, nucleară, ADN din cloroplaste sau alte medicamente ei. ADN-ul nuclear este de obicei de cel mai mare interes, deoarece servește ca o matrice pentru transcrierea genei. Apendicele 5 prezintă o diagramă a reglarea transcripției genei.
Prepararea ADN-ului din mitocondrii si plastide celulelor vegetale suficient de specifice. In aceasta lucrare ne sunt date considerare metodele utilizate pentru izolarea și purificarea preparatelor totale ADN, precum ADN-ul nuclear din țesuturi de plante superioare.
De preferință, izola ADN-ul din materialul vegetal proaspăt, care este înghețat imediat cu azot lichid, astfel inhibarea deoxiribonucleaza. azot lichid țesut congelat și organe ale plantelor, uneori stocate până izolarea ADN-ului la -20 ° C, Un material înghețat poate fi mărunțite la o pulbere liofilizată și depozitată la temperatura camerei, cu excluderea umidității. Chiar și a dezvoltat o metodă de izolare a ADN-ului de la planta obiecte alcool Fix-Rowan.
Faza inițială a procesului de extracție ADN - distrugerea membranelor celulare. Metodele existente de distrugere tisulară pot fi împărțite în trei grupe: 1) mecanică de măcinare, frezare, omogenizare; 2) utilizarea enzimelor, scindează în mod specific componente ale peretelui celular; 3) o combinație de perturbare mecanică enzimei de degradare. Pentru omogenizarea țesuturilor folosind tocător speciale cu cuțite rotative cu viteză mare: 10-40 mii rot / min .. Această metodă se aplică, de preferință la un tânăr, ușor de mărunțire țesuturile vegetale. Material fix a fost omogenizat în prezența etanolului.
distrugere mecanică satisfăcătoare a țesuturilor poate fi realizată prin măcinare într-un mojar răcit cu acid clorhidric spalata nisip de cuarț, pulbere de alumină, sticlă zdrobit. Metoda este utilizată pe scară largă pentru distrugerea diferitelor țesuturi, în special vegetative și generative organe mazăre murine mazăre, tutun, mere, crin, ceapa țesuturi meristematice de răsaduri de salată. Este folosit, de asemenea, pentru distrugerea materialului liofilizat. Mai puțin frecvente a fost o modalitate de a perturba celulele de diverse prese.
In ultimii ani, a început să se dezvolte în mod activ metode enzimatice pentru distrugerea membranelor celulare, ducând la prepararea protoplaști. Fără îndoială că avantajul lor - absența unor efecte mecanice dure nedorite, care conduc la degradarea moleculelor ADN-polimer de mare. Acest lucru este foarte important, dacă doriți ADN-polimer de mare, de exemplu, pentru a studia replicarea acestuia în celula pentru continuarea lucrărilor. Mai mult, prin utilizarea de protoplaști crește randamentul ADN-ului prin reducerea pierderii în diferite stadii de purificare a polizaharidelor, ceea ce permite reducerea cantității de materie primă la câteva grame. Cu toate acestea, pentru toate virtuțile sale, această metodă de extragere de ADN din protoplaști dificil de a obține protoplaști ei înșiși.
Având în vedere compoziția chimică a pereților celulelor, folosind diferite pekto- si enzime celulolitice pentru liza acestora. În primul rând, țesutul este macerate folosind Pectinaza. Cel mai activ printre pectinazelor cunoscute - matserozim izolate din ciuperca Rhyzopus, ceva mai puțin activ de droguri pektinol R-10. Distrugerea pereților celulelor este realizată într-un mediu care conține 0,4-0,7M manitol sau sorbitol, cu așa-numitele complecși celulaza - enzimă sisteme complexe, care includ C1-Cx-enzimă și celobiaza enzimă și hidrolizarea diferite tipuri de conexiuni în moleculele de polizaharide. Eficacitatea complexului celulaze depinde de prezența celor trei, și, eventual, mai multe componente individuale. Complexe celulaza izolate dintr-o varietate de surse, cunoscute sub numele de marcă. Utilizate pe scară largă, de exemplu, medicamente "Onozuka R-10" (Japonia) și "Sellulysin" (USA) derivat din Trichoderma viride, «Sellulase“ (SUA) - Aspergillus niger; industria casnică produce tsellokandin preparatele enzimatice, Celloviridin, tsellolignorin și ksilanigrin și xilanazei secretat de diferite microorganisme. Aceste medicamente pot fi de asemenea folosite pentru a prepara protoplaști de plante superioare.
De obicei, un perete celular liza cu succes experimental pentru fiecare compoziție a țesutului selectat și concentrația soluțiilor, pH-ul compoziției și concentrației de enzimă, timp de incubare și temperatura. Au fost elaborate condiții optime de obținere a protoplaste pentru o varietate de țesături.
Conform literaturii de specialitate, randamentul protoplast este de peste 95%. Protoplaștii sunt ușor distruse prin șoc osmotic sau detergenți. În acest caz, omogenatul a fost transferat nucleul intact și diversele organite celulare. protoplaști liză poate fi efectuată și în prezența detergenților, cum ar fi Triton X-100, Nonidet P-40.
Prepararea protoplaștilor de plante utilizate ca cloroplastică izolarea preparativă în fază intermediară și ADN-ul nuclear. Când acest lizat a fost centrifugat protoplaști cu gradient de densitate de zaharoză pentru separarea și prepararea organite subcelulare ale acestora preparate de ADN pur. Trebuie remarcat faptul că cerințele pentru protoplaști concepute pentru a izola ADN-ul de la acestea sunt diferite de cerințele, dacă este necesar, în continuare cultivarii lor atunci când problema informațiilor generate de păstrarea viabilității protoplaștii.
Rezumând cele de mai sus, se poate concluziona că metoda de selecție de distrugere a țesutului vegetal determinată de o sarcină finită de lucru, specificitate de țesut și alte cauze. Pentru distrugerea țesuturilor embrionare delicate omogenizare utilă, măcinare într-un mojar. Material fix sau țesut cu pereți celulari puternici se macină într-o moară cu mortar sau prin congelare cu azot lichid. Pentru a izola tipurile individuale de ADN (nucleare, cloroplastidiene), cele mai potrivite metode pentru distrugerea enzimatică a membranelor celulare.
Pentru mare de medicament polimer pentru a inhiba ADN-ul eliberat în timpul distrugerii nucleazei celulare. Compoziția aproximativă a celulelor este prezentată în Anexa 2. Pentru a reduce nucleazei proces de alocare activitate se desfășoară în rece (0 ° până la + 2 ° C), în care nu este optimă pentru acțiunile lor mediu alcalin. Când mediul de omogenizare este introdus în EDTA inhibitori tisulare, citratul de sodiu, și alți compuși care se leagă 2+ Mg. necesare pentru acțiunea deoxiribonuclează. În grade diferite inhiba DNază arseniat ion, fluorură și clorură de sodiu la concentrații mari, fenol (acid 4-amino-2-hidroxibenzoic), p-aminosalicilic acidă, detergenți, bentonită. Acesta este un inhibitor activ al acidului aurintrikarbonovaya deoxiribonucleazei la concentrații de 10-50 mM. Mai mult, datorită deoxiribonucleazei labilității termice parțial denaturat prin încălzire în lizatele tisulare la 55-60 ° C
Pentru prepararea total ADN după distrugerea liza celulelor de tesut este realizat si membrane nucleare. Deoarece agentul de degradare este cel mai des folosit cu dodecil sulfat de sodiu (SDS) (n-S12N25SO4Na) la concentrații de 1-5%. SDS promovează liza membranelor și a nucleelor crește randamentul și îmbunătățește deproteinizare ADN. efect SDS Deproteiniziruyuschy este că, pentru legarea sa la complexele proteice formate sunt solubile. SDS perturba intens hidrogenul si legaturile hidrofobe din molecule de proteine, dizolva multe proteine solubile anterior. complexe de proteine SDS devin sarcină negativă semnificativă datorită ion dodecil sulfo.
Regiunea hidrofile a proteinei
Fig. 1. Acțiunea detergent solubilizării cu membrana de proteine. În funcție de raportul dintre proteină și proteină solubilizată detergent în soluție poate fi în starea prezentată în figură, sau formează un complex cu miceliu detergent.
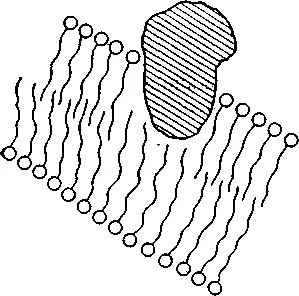

Pe lângă SDS, și alți detergenți sunt utilizate pentru lysing tesut: 1% triizopropilnaftalensulfonaților (izo-C3 H7) 3 C10 H4 SO3 Na, bromură de 1% cetiltrimetilamoniu (16H 24N (CH3) 3 N + Br -) (cetrimide) 4% sodiu dodetsilsarkozinat (C11 H21 CON (CH3) CH2 SOONa) (sarcozil). Fiecare dintre ele are propriile avantaje și dezavantaje. SDS precipită în frig și în prezența potasiului. Sarcozil insolubil în frig, dar formează săruri insolubile cu Mg 2+ și Mn 2+. Triizopropilnaftalensulfonaților inhibă în mod activ nucleaze, dar, de asemenea formează o sare insolubilă cu magneziu și mangan. În plus, ultimele două detergent absorb intens lumina la 260 nm. Dodetsilsarkozinat de sodiu utilizată în cazul în care purificarea planificată în continuare ADN de clorură de cesiu, deoarece, în contrast cu SDS se dizolvă în sare.
În plus față de detergenți, în amestec de liză enzime proteolitice administrate uneori de origine bacteriană, nu pierde activitatea la temperatură ridicată (60 ° C). proteinaza K eficientă în mod special ( «Sigma», SUA), care are o specificitate foarte larg substrat. Activarea acestei enzime este mai mult de 7 ori în prezența ureei și SDS se datorează în principal denaturarea proteinelor substraturi în aceste condiții.
După liza se efectuează de obicei deproteinizare multiplu rezultat lizat. Când acest lucru se întâmplă distrugerea legăturilor chimice care susțin structura trinară și cuaternară de proteine (tipurile și relațiile energetice din molecule biologice sunt enumerate în anexa 3). La aceasta s-a adăugat diferite conexiuni pentru disocierea complexelor nucleoproteinici (NaS1, NaS1O4. Urea) urmat agenți, denaturant proteine. Agenții de selecție deproteiniziruyuschih determinată de condițiile specifice și obiectivele de lucru suplimentar cu preparatele de ADN secretate.
În ciuda metodelor răspândite de deproteinizare ADN-ului, cu fenol și cloroform au o serie de neajunsuri serioase. Una dintre ele constă în distrugerea moleculelor ADN-polimer de mare în fragmente prin agitare mecanică deproteiniziruyuschimi cu acești agenți. Mai mult, există dovezi care extrage selectiv fenol prin satelit de tip ADN-AT, determină o creștere a pierderii de ADN în timpul izolării. fenol Procesare 10% reduce vâscozitatea ADN-ului, scade punctul de topire, aceasta duce la schimbări în regiunile bogate în GC perechi. Atunci când se utilizează pierderea cloroformul asociat cu membrane sau ADN heterocromatină pot aparea. Determinarea cantitativă a acizilor nucleici pierderilor datorate dublei tratamentului cu fenol și cloroform, sa constatat că a pierdut aproximativ un sfert din ADN. Când dublu tratamentul cu pierderea ADN cloroform este de 16%. Cloroform extrage selectiv ADN-ul mono-catenar:
54%, când cele trei tratamente.
Pierderea ADN cauzate de tratamentul cu fenol și cloroform, poate fi evitată prin utilizarea gradiente preparative SsSl. gradient de densitate ultracentrifugare permite obținerea preparatelor ADN înalt purificate. Prezența SsSl unei concentrații mari (2-4 M) împreună cu uree 5 M, uneori, rezultând disociere completă a complexului nucleoproteina. Principiul metodei de curățare constă în aceea că ADN-ul și impurități (ARN, proteine, polizaharide) diferă în densitate flotabilitate. SsSl și centrifugare densitate condiții sunt selectate astfel încât ARN-ul a fost precipitat pe fundul suprafață de proteine și ADN-ul a fost localizat aproape de centrul tubului.
Această metodă nu este la fel de simplu sau rentabilă în termeni de timp și echipamente, dar valoarea sa constă în faptul că este foarte eficient în prezența unor cantități mici de materie primă. După purificare prin centrifugare de echilibru în preparatele ADN SsSl conțin <1% РНК, <1% белка, характеризуются высоким гиперхромизмом, гомогенностью по молекулярному весу. Кроме того, очистка в градиенте СsСl позволяет избавиться от некоторых примесей, влияющих на скорость реассоциации ДНК.
curățare eficientă a sumelor preparative de ADN de plante poate fi realizată într-un amestec de bromură și etidium SsSl cu gradient de densitate. bromură de etidiu face bandă vizibilă a ADN-ului și permite de a inhiba hidroliza ADN-ului.
Spre deosebire de metodele de extragere a ADN utilizând centrifugare cu gradient folosind metode deproteinizare SsSl cu cloroform fenol și necesită purificarea suplimentară a ARN-ului din impuritățile preparatului. Metoda tradițională de purificare a ADN-ului a ARN - degradarea enzimatică a acestuia din urmă, în prezența pancreatice RNase A; în unele cazuri, care cuprinde suplimentar utilizarea RNazei T1. Simultan cu RNaza uneori recomandată utilizarea α-amilază pentru a îndepărta polizaharide reziduale în formulare. Modificările aduse soluției de ADN îndepărtat enzimele deproteinizare cu fenol sau cloroform și ADN-ul precipitat cu izopropanol.
Folosind metode de izolare a ADN-ului de plante, care se bazează pe o procedură Marmur, posibil să se obțină preparate de ADN satisfăcătoare purificate, dar randamentul ADN este relativ mică (10-20 mg / kg frunze proaspete).