hibridizarea orbital
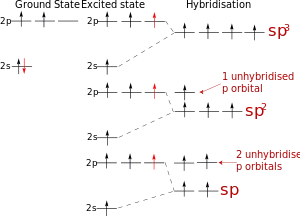
Schema de hibridizare a orbitalilor atomici de atomi de carbon
Conceptul de hibridizare a orbitalilor atomici de valență a fost propusă de chimistul american Linus Pauling să răspundă la întrebarea de ce prezența atomului central este diferit orbitali (s, p, d) valență formate datorită lor în moleculele poliatomice cu liganzi identici sunt echivalente în energia și caracteristicile sale spațiale .
Percepțiile de hibridizare sunt centrale metoda de legături de valență. Hibridizarea în sine nu este un proces fizic real, ci doar un model convenabil care permite explicarea structurii electronice a moleculelor, în special modificarea ipotetică a orbitali atomice în formarea unei legături chimice covalente. în special, alinierea lungimile legăturilor chimice și obligațiuni unghiuri în moleculă.
cu succes conceptul de hibridizare a fost aplicată descrierea calitativă a simple molecule, dar mai târziu a fost extins la mai complexe. In contrast cu teoria orbitalilor moleculare nu este strict cantitativ, de exemplu, este în imposibilitatea de a prezice spectre photoelectron molecule chiar simple, cum ar fi apa. Acesta este utilizat în prezent în principal în scopuri metodologice și în chimia organică de sinteză.
În 1954, Comitetul Nobel onorat Premiul L.Polinga în Chimie „pentru studii de natura legăturii chimice și aplicarea acestuia la explicarea structurii de molecule complexe.“ Dar el nu a fost introducerea L.Poling satisfăcută de σ, tt - Descrierile pentru o dublă și o legătură triplă și sisteme conjugate.
În 1958, la un simpozion dedicat memoriei lui Kekule. Pauling a dezvoltat teoria curbe legătura chimică. luând în considerare repulsia Coulomb a electronilor. Conform acestei teorii, dubla legătură este descrisă ca o combinație a două legături chimice curbate, și o triplă legătură ca o combinație a trei legături chimice curbate. [1]
Acest principiu a fost reflectat în teoria pereche de electroni repulsie Gillespie - Nyholm, prima și cea mai importantă regulă este formulată după cum urmează:
„Pair electronic primește o locație de pe stratul de valență al unui atom, în care acestea sunt distanțate la maximum unul față de celălalt, adică electroni perechi se comportă ca și în cazul în care acestea sunt respinse reciproc“ [2].
A doua regulă a fost că „toate perechile de electroni aparținând învelișului de electroni de valență, sunt considerate a fi situate la aceeași distanță de nucleu.“ [2]
sp-hibridizare

Aceasta are loc atunci când mixa audio și p-S orbitali audio. Format două orbitali atomici echivalent liniar sub un unghi de 180 de grade și îndreptate în direcții diferite de la nucleul central al atomului aranjate sp. Cele două rămase non-hibrid p-orbitali sunt aranjate în planuri perpendiculare reciproc și sunt implicate în formarea tt-obligațiuni sau perechi de electroni neîmpărtășite implicate.
sp 2 -hybridization
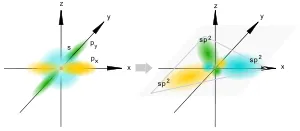
sp 2 hibridizare
Aceasta are loc atunci când se amestecă două audio și p S-orbitali. Trei orbitali hibride sunt formate cu axele dispuse într-un plan și îndreptate spre vârfurile triunghiului, la un unghi de 120 de grade. Non-hibrid orbitali p atomic perpendicular pe planul, și sunt de obicei implicați în formarea tt-obligațiuni
sp 3 -hybridization
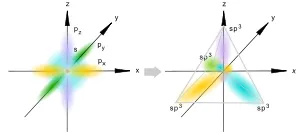
sp 3 hibridizare
Aceasta are loc atunci când se amestecă audio trei p-S și orbitali, formând patru echivalente în formă și sp 3 -Hybrid energia orbitală. Pot forma un patru sigma legături cu alți atomi sau umplut cu perechi de electroni singulară.
Axe sp 3 -Hybrid orbitali sunt direcționate către nodurile tetraedru. în timp ce nucleul atomului central este situat în centrul sferei circumscrise tetraedrului. Unghiul dintre oricare două axe aproximativ egal cu 109 ° 28 „[3]. care corespunde celui mai mic repulsia de electroni de energie. De asemenea, sp 3 orbitali pot forma un patru sigma legături cu alți atomi sau umplut cu perechi de electroni singulară. O astfel de condiție este tipică pentru atomii de carbon din hidrocarburi saturate și, respectiv, în care radicalii alchil și derivații acestora.
Hibridizarea și geometria moleculelor
Noțiunea de hibridizare a orbitalilor atomici sunt baza teoriei perechi de electroni repulsie Gillespie-Nyholm. Fiecare tip de hibridizare corespunde strict definit spațiale orbitalii orientare hibride ale atomului central, care permite utilizarea sa ca bază reprezentări stereochimice în chimie anorganică.
Tabelul prezintă cele mai comune exemple de tipuri de hibridizare a conformității și structura geometrică a moleculelor de pe presupunerea că toate orbitali hibride implicate în formarea legăturilor chimice (fără perechi de electroni nepuse) [4].
număr
orbitali hibride
- ↑ Editat de R. H. Freidlin. Chimie organică teoretică. - trans. din limba engleză. Cand. Chem. Stiinte Yu.G.Bundelem. - M. Editura literatura străină, 1963. - V. 1. - P. 11. - 365 s.
- ↑ molecule geometrie 12Gillespi R. / Trans. din limba engleză. EZ Zasorina și VS Mastryukova, ed. Yu. A. Pentina. - Mir, 1975. - P. 18-19. - 278 cu.
- ↑ Teoretic, acest unghi de tetraedru regulat este arccos (-1/3) ≈109 ° 28“.
- ↑ unde A - atomul central X - legarea orbitali hibride
- Wikimedia Commons conține materiale multimedia legate de hibridizarea orbitale
- Imagini animate hibridizare