Exploziile de amestecuri gaz-aer
Dacă capabil de a aprinde amestecul de gaz combustibil este într-un spațiu închis, cum ar fi în interior, aparatul sau cu diametrul conductei suficient de mare, la apariție, în orice punct al volumului de flacără deschisă, o scânteie electrică sau corpului încălzit, a cărui temperatură este suficientă pentru aprinderea gazului, are loc explozia . Explozia este un fenomen de aprindere extrem de rapidă și arderea tuturor amestecului de gaze volum disponibil imediat. Explode nu poate doar combustibil gazos. În anumite circumstanțe, explozii pot apărea amestecuri de vapori lichizi cu aer combustibile și praful în suspensie în aer combustibililor solizi.
arderea rapidă a combustibilului în explozie însoțită de o creștere foarte rapidă a temperaturii și, în consecință,
o creștere bruscă a presiunii de gaz încălzit. Este practic instantanee și creșterea bruscă a presiunii într-un volum închis, care se ocupă cu amestecul combustibil înainte de explozie, poate duce la consecințe devastatoare. Presiunea generată de explozia amestecurilor gaz-aer poate fi de până la 0.7-.8 MPa, în cazul în care amestecul la explozie sunt la presiune atmosferică normală. În cazul în care amestecul de gaze înainte de explozie a fost deja la o presiune ridicată, presiunea exploziei este atât de mare ca presiunea amestecului a fost - peste normal. La presiune explozii amestecurile de gaz de oxigen poate fi considerabil mai mari decât în explozii ale amestecurilor gaz-aer.
Amploarea dezvoltării în explozia amestecului de gaz de presiune, poate fi determinată cu ajutorul formulei:
Rvzr în care - presiunea absolută timpul exploziei MPa;
Rnach - presiune absolută inițială a amestecului, MPa;
tvzr - temperaturile în curs de dezvoltare în timpul exploziei care sunt limita valorii maxime;
Tstart - temperatura inițială a amestecului de gaz; ° C;
m - numărul de volum (m 3) de gaz a produselor de ardere, cu luarea în considerare azotul atmosferic;
n - numărul de volum (m 3) de amestec aer-gaz la explozie, de asemenea, luând în considerare azotul atmosferic.
Deoarece, temperatura maximă de ardere este aproape nu atins, ci un amestec de gaz și aer numai ar putea fi accidental astfel încât nu va exista nici un exces în ea, nici lipsa aerului în comparație cu cantitatea teoretică, presiunea efectivă în explozii de gaze va fi mai mică decât maximul posibil, t e. 0.7. - 0.8 MPa. Deosebit de periculoase împotriva gazelor de explozie sunt mai mici LEL, deoarece, în acest caz, amestecul gazos se formează mai degrabă capabil ceteris paribus Ignite. În valori apropiate lel două gaze una periculoasă, care are arie mai largă de explozie și sub temperatura de aprindere.
Pentru gaze Cm · ecuație chimică Hn reacția de ardere a oxigenului sub formă
în care numărul m- carbon al gazului de hidrocarburi;
n - numărul de atomi de hidrogen din gazul;
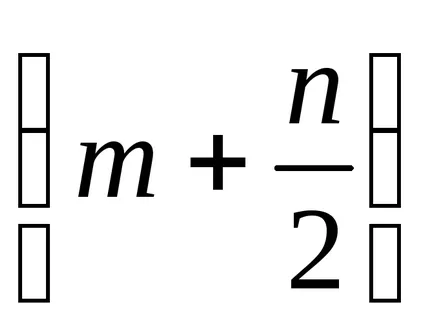
În conformitate cu formula (8), ecuația pentru arderea gazelor combustibile ar fi:
Din punct de vedere practic oxigenul a gazelor de ardere nu este luată în forma sa pură, ci ca parte componentă a aerului.
Deoarece aerul constă în volum de 79% azot și 21% oxigen din volumul de oxigen per necesită 100. 21 = 4,76 volum de aer sau 79. 21 = 3,76 volum azot.
Astfel, reacția de ardere a metanului în aer poate fi descris printr-o ecuație de forma
Din această ecuație este clar că pentru arderea de 1 m3 de metan necesar 2 m 3 de oxigen și azot, sau 7,52 + 7,52 = 2 9,52 m 3 de aer (vezi. Tabelul 6).
Proprietățile toxice și gazele sufocant
Gazul natural (metan, etan, propan, butan, etc.) altele decât cele care conțin cantități apreciabile de hidrogen sulfurat nu sunt, de obicei toxice. Cu toate acestea, la concentrații mari de gaze naturale în aer există o lipsă de oxigen până la asfixiere. Prin reducerea conținutului de oxigen din aerul inhalat sunt observate: fiziologice următoarele stări 17% - dificultăți de respirație și palpitațiile, la 12% - respirație foarte constrânsă, cu 9% - leșin. Metan omologi - etan, propan, butan, sunt, de asemenea, conținute în gazele naturale de a acționa asupra omului ușor narcotice.
Tabelul 6 - numărul de oxigen și aer în timpul gazelor de ardere
ecuația universală a gazelor de stat, am analizat în capitolul 3. În plus, o privire la ecuația de stare a gazului cu coeficienții virial
În această ecuație, factorul Z supercompressibility reduce la o serie de putere. B, C, D - coeficienți virial respectiv duble și cvadruple triple sunt o funcție numai de temperatură și depind în mare măsură de interacțiunile moleculare în care se cuplează simultan, respectiv, două, trei și patru moleculele de gaz. Coeficienții Virial și determinarea factorilor supercompressibility exact numai posibil pentru gaze constând din molecule simple, de exemplu, oxigen, azot.
Conform teoriei cinetice-moleculare cu un factor de luat în considerare puterea Z. interacțiune moleculară Și dacă Z <1 то преобладают силы притяжения если же Z> 1 este dominat de forța repulsivă la Z = starea 1 a forțelor de echilibru molecular.
Figura 1 prezintă factorul de comportare supercompressibility variație în funcție de presiunea la gaz cu temperatura constantă.
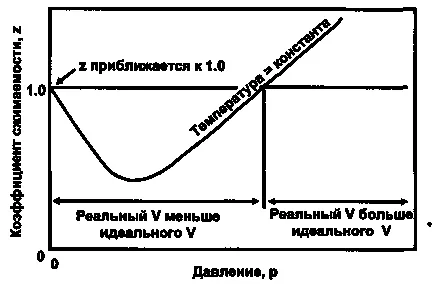
Figura 1. Un raport tipic schimbare graficul supercompressibility de presiune la o temperatură constantă
Determinarea mai larg factorul supercompressibility pentru amestecurile de gaze din zăcămintele de gaze naturale la presiuni de până la 70 MPa obținute prin metoda de determinare a graficului prezentat în figura 2. în acest grafic bazat pe construirea principiului stărilor corespunzătoare, și anume pentru aceleași valori presiunile și temperaturile date RPR substanțe Tcal diferite au valori similare factor supercompressibility Z.
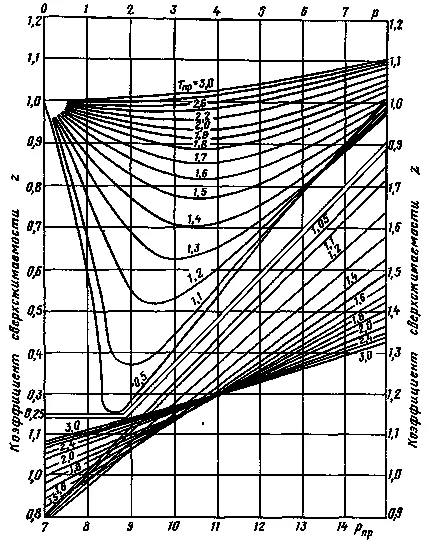
Figura 2. Dependență factor supercompressibility Z a gazelor naturale din presiunea de mai sus și temperatura.
Metode de determinarea factorului supercompressibility al Z este următoarea. Inițial, figurile 2 și 3 sau formula (2), în funcție de densitatea relativă și compoziția gazului se determină presiune srednekriticheskie și temperatură, precum și pentru presiunea dată și temperatura.
Srednekriticheskie (pseudocritical) presiunea și temperatura amestecului poate fi calculată în conformitate cu formula (2):
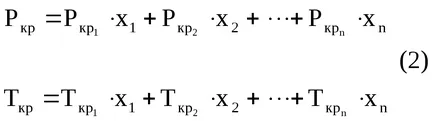
în cazul în care x1. x2 ..., xn - fracțiunile de volum ale componentelor compoziției gazului;
Rkr1. Rkr2 ... Rkrn - componentele critice de presiune;
TP1. TR2 ... Trn - temperatura critică a componentelor.
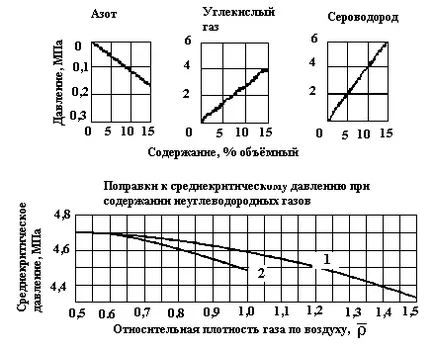
Figura 3. Dependența de presiune asupra srednekriticheskogo densitatea relativă a gazului în aer: 1 - câmpuri de gaze; 2 - campuri gaz condensat (
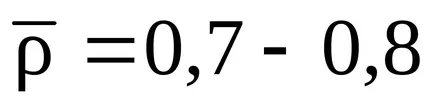
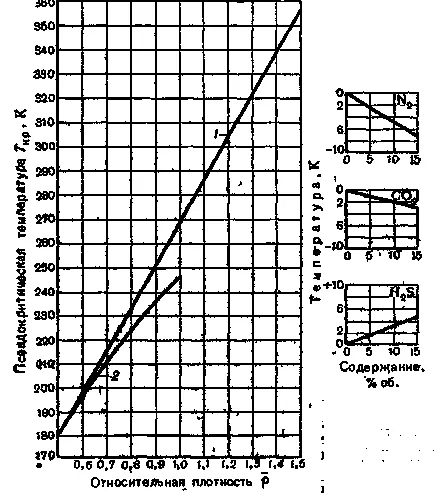
Figura 4. Dependența de temperatură srednekriticheskoy pe densitatea relativă a gazului în aer:
1 - zăcămintele de gaze;
2 - câmp de gaz condensat ().
În cazul în care conținutul de gaz N2. CO2 și H2 S peste 15% din ecuația de volum poate fi utilizat în locul graficelor pentru determinarea și Tcr PCR (2).
În continuare, dependența prezentată în figura 1 este determinată și RRP corespunzătoare și TPR valoarea factorului supercompressibility Z.
Tabelul 1 prezintă detalii ale unor parametri fizico-chimice ale componentelor incluse în gazul natural.
Așa cum am menționat anterior, în condiții de rezervor în domeniile de condens sunt hidrocarburi cu punct de fierbere ridicat (C5 + H12), care sunt prezente în compoziția fracțiunilor de benzină, kerosen și ulei de fierbere la temperaturi de până la 500 ° C Masa fracției etan și propan - fracția butan atinge 25%
Tabelul 1. Proprietățile de bază ale componentelor gazelor naturale
În compoziția de fierbere ridicat sistem cu rezervor de hidrocarburi condensat conținut trei grupe chimice hidrocarburi: metan, naftenice și aromatice, precum și relațiile lor sunt foarte diferite de diferite depozite gaz condensat. Tabelul 2 prezintă o scurtă descriere a unui număr de CSI depozite gaz condensat.
cu cât presiunea de formare și temperatura. Trebuie remarcat că condițiile de formare a depozitelor poate afecta în mod semnificativ un model.
În acest sens, în natură se pot întâlni trei tipuri de depozite de gaz condensat - saturate si subsaturat supraîncălzit. Pentru acest ultim tip de depozite caracteristic că temperatura rezervorului deasupra sistemului critic rezervor de temperatura de condensare.
Sistemul de condens format saturat dacă în timpul formării depunerilor există surse de alimentare de hidrocarburi cu punct de fierbere ridicat al fazei gazoase (buză ulei sau câmpurile petroliere lângă culcat).
Tabelul 2. condensatele caracteristicile calitative
Sistemele de rezervor ciupite chiar și la un conținut ridicat de C5 + hidrocarburi înălțimea la gazele de presiune din rezervor este întotdeauna sub formarea de rouă.
Trebuie remarcat faptul că o trăsătură caracteristică a condensatului de gaz este de a reduce concentrația de etan pentru propan și propan butan, în timp ce în gazele de petrol, a declarat regularitate este absent.
Depozitele gaz condensat, această valoare este de 2 - 6. Raportul dintre metan la valoarea C1 / C2 + hidrocarburi grele într-un depozite condensat gaz este de aproximativ 10, în timp ce în gazele dizolvate în ulei la 13.
- Conținut scăzut de sulf și maloaromatizirovannye;