Enzimele, stomatologie terapeutică
Enzime placa au fost obiectul unor studii detaliate numai în ultimul deceniu. Lucrarea cea mai fundamentală a studiului au fost efectuate de către oamenii de știință scandinavi.
Studiul efectului proteazelor plăcii hemoglobinei, esterii α-1-amino-1, și poli-aminoacizi au arătat că rata de hidroliză a hemoglobinei este direct dependentă de concentrația unei suspensii a plăcii dentare și a hemoglobinei. pH optim pentru hidroliza hemoglobinei a fost de 7,5-8,0. ester tosil-arginin-metil Hidroliza a fost maximă la pH 10,1. De asemenea, acest substrat, proteaza digerat placa bAee (ester etilic benzoil-arginină) și ATEE (ester etilic al acetil-tirozina). Odata cu aceasta, digerate ușor polilizina proteaza, cu un pH optim 9-10. În același timp, enzimele plaque, spre deosebire de pepsină, papaină, tripsina, ficin, acid poli-1-glutamic nu a fost scindată.
C prin filtrare pe gel pe Sephadex G-100 și G-200 a plăcii dentare umane au fost izolate două proteaze, dintre care una era activă împotriva gelatină, iar al doilea, împreună cu gelatină hemoglobină clivată ușor. Prima proteaza a avut o greutate moleculară de aproximativ 200.000, 8,5 pH optim și activate de ionii de calciu. O a doua protează a avut o greutate moleculară de 40 000-50 000, pH-ul optim pentru clivarea hemoglobinei și 7,8, de asemenea, activat de ionii de calciu. Atât proteaza ușor inactivat timp de 5 minute în timp ce încălzirea la 70 ° C
Dacă purificarea ulterioară a proteazelor selectate efectuate folosind zona de electroforeză obținută enzime foarte purificate. Prima greutate moleculară ridicată, ușor scindează poli-1-lizină, în timp ce a doua enzimă nu acționează pe acest substrat. Ambele gelatina digerată proteaza, lauril activat și la un grad mai mic fluorură de sodiu; Inhibitorii acestor enzime este EDTA, laurii (în special al doilea proteaza) și inhibitor de tripsină din soia. Ambele proteaze prezintă o stabilitate maximă între pH 3,5-8,5
Utilizarea împreună cu Sephadex agaroza a permis detectarea prezenței activității a treia proteinazei față de hemoglobină și gelatină. Această protează are o greutate moleculară în intervalul de la 40 000-50 000.
Mai târziu, în placa rezultată detectat 4 grup de enzime proteolitice care sunt separate unele de altele prin filtrare pe gel pe Sephadex G-100. Folosind metoda de focusare izoelectrică a plăcii au fost enzime proteolitice izolate având puncte izoelectrice pl 4, 4,6 5,9, 6,8. Greutatea moleculară a acestor enzime este în intervalul de 20 000-150 000.
Placa gasit enzime umane, este extrem de ușor de a cliva a- și beta-L-naftilamidei ppolina și L-hidroxiprolina (Makinen, 1969). În plus față de aceste peptidaze specifice sunt evidențiate, de asemenea, ușor peptidazei nespecifice scindează naftilamidei L-alanină, L-metionină, L-leucină și L-fenilalanină. Acest peptidaza nespecifica inactivat ușor parahlormerkuriybenzoatom. Totul a studiat lactobacili sintetizat naftilamidazy.
Plaque colectate la copiii cu gingivită are activitate proteolitică de 5 ori mai mare decât cea a copiilor sănătoși. Cu toate acestea, aceste diferențe pot fi din cauza inegale de plăci la copii de gingivită sănătoase și bolnave.
Studiul compoziției calitative a enzimelor proteolitice izolate din placa dentară copii și adulți, a arătat absența oricăror caracteristici în profilul cromatografic al acestor enzime.
Studiile hialuronidaza in placi este de interes special datorită faptului că această enzimă capabilă să scindeze acid hialuronic - substanța extracelulară de bază a țesutului conjunctiv - și crește astfel permeabilitatea acesteia. Cel mai profund și mai cuprinzător studiu de placa de hialuronidază au avut loc un grup de oameni de știință suedezi. Folosind metoda viscometry, au găsit o activitate de hialuronidază în placa dentară umană și a examinat unele dintre proprietățile sale. O variație semnificativă a activității enzimei la indivizi. Enzima a avut două 5,5 pH-ul optim și 6,5, indicând prezența mai multor izoformă. Când filtrarea gelului pe Sephadex G-200 a fost arătat prezența a două vârfuri având activitate de hialuronidază. Este interesant de observat că placa hialuronidaza este relativ stabilă la temperatura de 4-4 0C, dar foarte slab tolera congelare. Astfel, după 12 zile de stocare la 4 0C păstrate peste 60% din activitatea hialuronidazei inițială, în timp ce la o temperatură de -20 0C - doar aproximativ 11%. C prin filtrare pe gel pe Sephadex și Biogel găsit mai multe forme de hialuronidază în placa dentară. Aproape toate dintre ele au avut pH-ul optim 6,5; Primul vârf a avut un optim suplimentar la pH 5. O caracteristică interesantă este relativă enzimă termostabilitate hialuronidază primul vârf, în timp ce al doilea vârf diferă termolabilității de urgență.
Metodele de fracționare sare, cromatografia de schimb ionic pe filtrarea pe gel DEAESephadex A-50 de pe Biogel, izozlektricheskogo concentrandu-se si doua filtrare prin gel succesive pe un hialuronidază obținut de preparare Biogel, purificată 14 până la 500 de ori într-un randament de 4,4%. placa de hialuronidază este o origine microbiană, la fel ca în macrofage și țesuturi kostnoi activitatea hialuronidazei conectat la pH 6,5, cu toate că există o activitate corespunzătoare la pH 3,5-4.
Prin intermediul focusare izoelectrică a plăcii dentare umane sunt două hialuronidaza distincte izolate, ale cărui proprietăți sunt foarte asemănătoare cu hialuronidază izolate din cultura plăcii dentare. pH-ul optim pentru prima enzimă este 5-5,2, iar pentru al doilea - 6.2. Ambele enzime sunt cele mai stabile, la o valoare de pH 5-8, ele sunt rapid inactivate atunci când este încălzit peste 50 ° C Am găsit aceste enzime 4 fracțiuni cu o greutate moleculară de 300.000, 200.000, 150.000 și 100.000.
Sursa plăcii hialuronidazei, așa cum sa arătat mai sus, sunt microorganismele cu producătorii cei mai activi ai hialuronidazei sunt Staphylococcus aureus și Streptococcus mitis, și corinebacterii aerobe și anaerobe. Toate celelalte tipuri de microorganisme capabile să producă această enzimă.
PH-ul optim al hialuronidaza este în intervalul 5,1-6,2, punctul izoelectric este 8. hialuronidaza este stabilă la valori pH de 5-9, dar enzimă mai degrabă termolabile.
La pacienții cu gingivită și diabet constatat o activitate foarte ridicată hialuronidazei a plăcii dentare.
In placa umană a constatat prezența lizozimului. Aproximativ 70% din activitatea lizozima este concentrată în fracția sedimentară a plăcii. Enzima are un pH optim de 5,1, la fel ca lizozima umană, foarte stabil și în următoarele două zile nu alterează activitatea lor atunci când această valoare a pH-ului. Activitatea Lizozimul placi diferite discipline variază în mare măsură. Sursa de placa lizozim, în toate probabilitățile, este saliva. Folosind focusare izoelectrică lizozimul izolate într-o stare purificată; reprezintă un singur izo-formă, spre deosebire de lizozimul prezent în leucocite. In studiul activității lizozima în dinamica formării plăcii a constatat că această activitate este de cel puțin placa de maturare tinde să scadă.
In plus fata de aceste enzime sunt prezente în fosfatază placi, neuraminidaza, lactat dehidrogenaza, și un număr de alte enzime ale defalcării căii glicolitice a glucozei.
Cu metoda cromatografică a plăcii dentare de mai multe fracțiuni umane fosfatazele izolate hidrolizează fosfat paranitrofenil. Enzimele au un pH optim de 5,6, și au o stabilitate considerabilă într-o gamă largă de pH. Fracțiunea acelular a plăcii dentare uman detectat acid (cu un pH optim de 5,5) și alcaline (cu un pH optim de 8,5), sursa fosfatazei acestor fosfataze, după toate probabilitățile, sunt microorganisme.
Streptococi placa supragingivală produc dekstranglyukozidazu (dextranazei) capabile în condiții acide blânde pentru a scinda glucoza din dextran.
In placa uman găsit-amilază, glitseralde-gidfosfatdegidrogenaza, lactat dehidrogenaza, glucozo-6-fosfat, succinat dehidrogenaza, glutamatdegidrogenaza, lipoamid dehidrogenaza și glutation peroxidaza, oksibutiratdegidrogeneza, malat dehidrogenază, dehidrogenaza isocitrate, phosphogluconate dehidrogenaza, peroxidaza, DNAza I, RNaza și plasmina.
Am constatat că activitatea enzimelor antiplacă (acidă și alcalină fosfatazei, proteaza alcalină, catepsina pH 3.5) variază în timpul dezvoltării sale După cum se poate observa din Fig. 3, activitatea fosfatazei acide este redusă încet și ușor în primele 8 ore de formare a placii a fost semnificativ redusă de 12 ore timp de noapte, dar până la sfârșitul zilei dramatic crește activitatea.

Imaginea este similar cu fosfatază alcalină, pentru care noapte (12 ore), se caracterizează prin cel mai scăzut nivel de activitate. Placa asamblate pentru 24 de ore, activitatea acestei enzime este foarte mare. Activitatea proteazei alcalină este crescută progresiv, atingând un maxim până la sfârșitul zilei, în timp ce activitatea katepticheskaya, în schimb, tinde să scadă treptat.
Rezultatele determinării activității enzimatice în placa dentară (1-9 zile), în condiții normale de alimentare, sunt prezentate în Fig. 4.
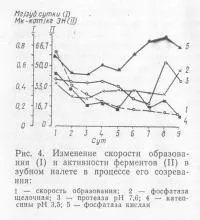
Datele arată că activitatea fosfatazei acide, atingând valori ridicate în prima zi, în timpul zilei 2 și 3 a redus semnificativ, și creșteri suplimentare secvențial, atingând valorile maxime în ziua a 8. Activitatea fosfatazei alcaline la 2- 3-a zi scade, apoi cu 4 până la 8-a zi se bazează pe același nivel, există puține diferit de valoarea sa în ziua 1 și numai în ziua a 9-a crescut dramatic . Activitatea proteazei alcaline are valori maxime la formarea prima placă zi și apoi scade treptat până la 7-a zi. În această perioadă, activitatea enzimei este de aproape 2 ori mai mic decât nivelul inițial. Activitatea ka-tepsinov pH 3,5 în orice moment tinde să scadă, iar cea mai mică cifră pentru această enzimă sunt observate în ziua a 9.