energie chimică de legare (d) - cantitatea de energie care este eliberată în timpul formare a
Pentru moleculele poliatomice cu energia de legare omogene pentru obligațiuni, a adoptat valoarea medie calculată prin împărțirea energiei formării compusului atomilor pe numărul de legături. Astfel, din moment ce energia este absorbită în H2O = 2H + D este egal cu 924 kJ / mol și o moleculă de apă, ambele O - H sunt chimic echivalente, legarea medie a energiei D (O-H) = Ddiss. ./2 = 924/2 = 462 kJ / mol.
O caracteristică importantă a legăturii chimice este lungimea l sa. egală cu distanța dintre miezurile în conexiunea. Depinde de mărimea cojile de electroni, precum și gradul lor de suprapunere. Pentru același tip de comunicare este o corelație certă între lungimea și energia de legare: o dată cu scăderea lungimii legăturii, de obicei, crește energia de legare și, în consecință, stabilitatea moleculară. De exemplu, pentru un număr de molecule în halohidrați
l (HF) creșterea distanței de comunicare și scade sale energetice D (H-F)> D (HCl)> D (HBr)> D (HI). Principalele tipuri de legături chimice sunt ionice, covalente și metalice. Liantul ionic este o interacțiune electrostatică dintre ionii încărcați negativ și pozitiv într-un compus chimic. O astfel de comunicare are loc atunci când o diferență mare de electronegativitate a atomilor implicați în formarea de legături. O situație similară apare cu formarea de legături între cationii s-elemente (metale) din prima și a doua grupe ale sistemului periodic și anioni nemetalelor din grupele VI și VII (LiF, CsCI, K2 O și colab.). Diferența ridicată în atomii (EO) electronegativitate produce un transfer aproape completă a electronilor din atomii de EO la atomi scăzute cu ee ridicat și ionizarea lor. Ca urmare, contribuția dominantă în energia de legare contribuie interacțiunea Coulomb dintre ionii încărcați opus. Este o legătură chimică covalentă formată prin perechi de electroni împărtășite de doi atomi. Atunci când distanța dintre doi atomi, de exemplu atomi de clor, orbitalii lor se suprapun apare. Ca rezultat, densitatea de electroni între nucleele atomilor este crescută și nucleele sunt atrași unul de celălalt. Atunci când convergența excesivă crește repulsie nucleelor. Antagonismul acestor două forțe determină minimul de energie potențială în curba de interacțiune atomi egală cu energia de legare. Aceasta corespunde unei distanțe minime optime între nucleele, egală cu lungimea LSV conexiune. Caracteristicile unei legături chimice covalente este focalizarea și saturarea acestuia. Deoarece orbitalii atomici sunt orientate spațial, ele se suprapun în anumite zone, ceea ce duce la orientarea legăturii covalente. Cantitativ, orientarea este exprimată ca legătura unghiurile dintre direcțiile de legături chimice în molecule. Saturability legătură covalentă este cauzată de limitarea numărului de electroni implicați în formarea sa. Un parametru util pentru a descrie dimensiunea unui atom implicat în formarea unei legături covalente este o rkov raza covalentă. Este definit pentru un atom ca X jumătate din lungimea unui tipic simplu conexiune homonucleare X-X. Dacă o legătură covalentă este format din aceiași atomi, de exemplu N-H, O = Oh și colab., Care sunt distribuite în mod uniform împerecheat electroni între ele. O astfel de legătură se numește legătură covalentă nepolară. Dacă unul dintre atomii este mai electronegativ decât cealaltă, perechea de electroni deplasează spre atom mai electronegativ. În acest caz, o legătură covalentă polară. Cu cât mai mare diferența în electronegativities atomilor ce formează legătura, cu atât mai mare polaritatea conexiunii. Ca urmare a deplasării electronilor de la un atom la altul sarcină negativă parțială este formată pe una dintre ele (mai electronegative) (), pe de altă parte - o sarcină pozitivă parțială (). Acest lucru duce la un dipol - sistem neutru, cu cele mai mari două sarcini pozitive și negative identice situate unul față de celălalt la o distanță lD. numita lungime dipol. O măsură a polarității de conexiune este un moment de dipol electric. egală cu produsul dintre taxa efectiv pe lungimea de dipol legătură covalentă cu Polar. aproape de 1, poate fi considerată o legătură ionică. Cu toate acestea, chiar și compuși ionici de mai jos unitate. De aceea, orice legătură ionică are o anumită parte din covalency. Descriind distribuția electronilor în molecule folosind două metode de bază de calcul: metoda legăturilor de valență (BC) cât și metoda molecular orbital (MO). Metoda de legături de valență Sun se bazează pe următoarele ipoteze-cheie: a) legătura chimică dintre cei doi atomi apare ca urmare a suprapunerii AO pentru a forma perechi de electroni (generalizate doi electroni); b) atomii care formează o legătură, este schimbată între electronii care formează perechi de legare. schimbul de energie de electroni între atomii (atomi de energie atracție) contribuie la energia de legare. Contribuția suplimentară la energia de legare a forțelor de interacțiune Coulomb da particulelor; c) legarea chimică a implicat electroni cu spin opus; Caracteristici g) lipirea chimică (energie, lungime, polaritate, etc.) este determinată de tipul de suprapunere AO. Structura electronică a moleculei diferă foarte mult de structura electronică a atomilor constituente. De exemplu, orbitalii de electroni ai moleculei de hidrogen nu are simetrie sferică, spre deosebire de un atom de hidrogen AO, deoarece perechea de electroni în două centre aparține sistemului molecular. În același timp, perechea de electroni de legare este la un nivel de energie mai mic decât electronii nepereche atomilor de hidrogen. Ca rezultat, formarea moleculelor din atomii în curs de transformare doar structura electronică a atomilor exterior coajă și predvneshnih. De aceea, în care rezultă atomii de molecule cu structura electronică originală nu există. In atomii in molecula sunt păstrate numai configurația electronică a cojilor de electroni interioare, care nu se suprapun cu formarea de legături. Capacitatea de a atașa atom sau înlocui un anumit număr de alți atomi pentru a forma legături chimice numite valență. Conform metodei Sun, fiecare atom face formarea de perechi de electroni de ansamblu (legătura covalentă) ca un electron nepereche. O măsură cantitativă a mecanismului de schimb de valență al forțelor armate ale metodei este numărul în sol sau în stare excitată de electroni neîmperecheați atomului. Acestea includ electronii nepereche ale cochilii exterioare ale atomilor și elemente p S-și coji exterioare predvneshnih elemente d-. La formarea atom de legare chimică poate muta într-o stare excitată ca urmare separarea perechii sau a perechilor de electroni și trecerea unuia (sau mai mulți electroni egal cu numărul de vapori separați) orbitală a învelișului liber al acestuia. De exemplu, configurația electronică a calciului în starea solului 2 este scrisă ca 4s. În conformitate cu o metodă de soare valență mecanism de schimb este nulă, adică pentru Ca (... 4s 2) valentnostV = 0. La atomul de calciu, în al patrulea shell (n = 4) sunt p orbitali vacante. Când excita atomii și electronii se produce abur 4S- un electron liber se mută la 4S- orbital. valență de calciu în stare excitată este egal cu doi, adică, Aburire la o valență crește cu două unități. Structura spațială a moleculelor. Așa cum sa arătat anterior, legătura chimică covalentă este direcțională, care se datorează determina orientarea JSC în spațiu. Bond format prin suprapunerea AO linie care unește nucleele combină atomii se numește # 963; -bond. exemple de educație # 963; -bonds sunt s-orbital se suprapun, p-S și orbitali, a p-orbitali, d-orbitali, precum d- și s-orbitali, orbitali d- și p, etc. Unele dintre exemple # 963; -bonds enumerate mai jos.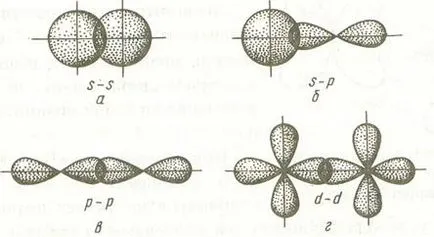
Puteți vedea că, în cazul # 963; zona -bonds de densitate maximă a electronilor este pe linia care leagă nucleele atomilor.
Bond format prin suprapunerea AO pe fiecare parte a liniei care unește nucleele atomilor (suprapunere laterală) se numește π-bond. π-legătură poate fi formată prin suprapunerea p-p, p-d, f-p, f-d și f-f-orbitali. Mai jos sunt exemple de formarea tt-obligațiuni.
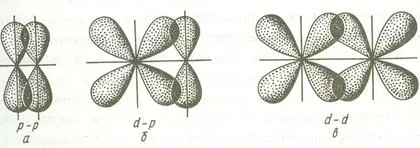
Deoarece formarea de gradul tt-obligațiuni de suprapunere a orbitali este mică în comparație cu # 963; -bond, energia acestor obligațiuni este semnificativ mai mic.
La aplicarea π pe conexiune # 963; -bond legătură dublă formată, de exemplu, moleculele de oxigen, etilena, dioxid de carbon:
La aplicarea celor două tt-obligațiuni pe # 963; -bond apare o triplă legătură, de exemplu, în moleculele de azot, acid acetilenă, cianhidric:
Cu cât multiplicitate de comunicare, cu atât mai mare de energie și inferior lungimea legăturii.
Unele forme ale compușilor nu pot fi explicate în termenii formării lor atomilor excitați sau neexcitat. Astfel, toate link-urile din molecula de metan C-H sunt egale, ceea ce contrazice setul de orbitali din atomii de carbon formează excitate și neexcitat. Sprijinul consistent al acestei și a altor fapte găsite în cadrul conceptului de hibridizare SA.
Hibridizarea - un amestec de diferite forme și energie orbitali de atomi, având ca rezultat formarea de același număr de orbitali de energie și formă hibride identice. Echivalenta orbitali hibride responsabile nu numai pentru formarea de legături echivalente de energie, dar, de asemenea, legătură similară unghiurilor dintre legăturile formate de acești orbitali. Trebuie subliniat faptul că hibridul format AO un atom având o diferite orbitali, în care hibridizarea orbital obiect sunt cu energii similare.
În cazul metanului, hibridizarea este rezultatul amestecării celor trei p-S și orbitalii audio în stare excitată de atomi de carbon, așa-numitul sp3 hibridizare.
Formarea orbitali hibride provoacă în mod avantajos energie prin acești compuși chimici orbitali. Acest lucru se datorează doi factori.
În primul rând, orbitalii hibride sunt asimetrice, ceea ce determină un grad mai mare de suprapunere în formarea legăturilor chimice și puterea lor mare.
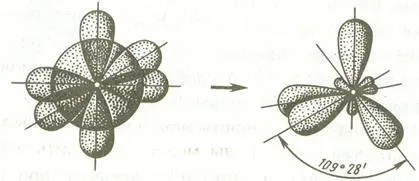
În al doilea rând, legătura dintre unghiurile orbitalii hibride mai mari de non-fuziune, rezultând într-un grad mai redus de repulsie între legăturile electronilor formate de aceste orbitali și face sistemul molecular mai stabil.
Când sp 3 -hybridization axei longitudinale a orbitali hibride de simetrie sunt situate una față de cealaltă, la un unghi 109º28 „- către colțurile respective ale unui tetraedru, centrul căruia este nucleul unui atom.
Dacă Hibridizarea este un obiect s și două p orbitali, un astfel de tip se numește hibridizare sp 2 - hibridizare și unghiurile dintre axele longitudinale ale acestor orbitali sunt egale și 120C corespund repulsia minimă dintre electronii de valență.
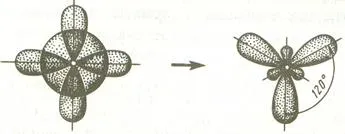
Când s- audio mixat și p-orbitali o deține SP-hibridizare. În acest caz, unghiul dintre valență orbitali hibrid 180 # 730; S.
Structura spațială a moleculei este determinată de numărul de atomi în moleculă, hibridizarea orbitali și numărul de electroni nepereche pe ele responsabile de formarea de conexiuni.
Molecula formată de doi atomi este liniară. În cazul în care învelișul exterior al atomului are două p electron nepereche, apoi suprapunerea lor orbitali AO alți atomi, molecule formate unghiulare. Astfel de atomi includ atomii de grupă elemente p-VI (O, S, Se, Te), configurația electronică a cochilii exterioare din care sunt prezentate mai jos.