Determinarea echivalenților metalice
Apoi, într-un tub de reacție genunchi 3, așezați o bucată de metal. masa de metal menționată pe o hârtie în care a fost înfășurat, nota în tabelul. 1.1.
In alt genunchi tub de turnare 3 cu soluție de acid clorhidric până la un al treilea volum. Strâns pus pe tubul 3 în fișa 5 tubul de vapori.
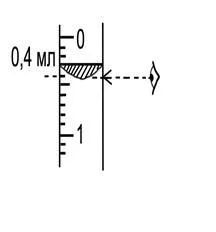
Din nou, verificați aparatul pentru scurgeri. Dacă dispozitivul este sigilat, citirile nivelului apei (V1) în registrul biuretă de măsurare în tabel.
Ridicarea tubului 3 se toarnă acid în genunchi cu metal. Nascent apa stramuta de hidrogen dintr-o biuretă în biureta 1 2. După terminarea reacției (încetarea eliberării de hidrogen), așteptați 3-5 minute la conținutul tuburilor de reacție au fost răcite la temperatura camerei.
Apoi biureta auxiliar 2 inferior, astfel încât nivelul apei în ambele biureta la aceeași înălțime. La niveluri egale de apă din interiorul unității la presiunea atmosferică.
În această poziție biurete măsoară nivelul apei (V2) în înregistrarea biuretă de măsurare 1 și tabelul. 1.1.
1. Determinarea presiunii parțiale de hidrogen.
Vaporii de apă din aer are o presiune parțială notabilă. Pentru a determina presiunea parțială a hidrogenului, este necesar să se elimine presiunea vaporilor de apă saturată, care se află în tabelul 1.2, la o experiență de temperatură corespunzătoare.
- Sfârșitul lucrării -
Acest subiect apartine forumului:
Atunci când se lucrează în laborator trebuie să respecte următoarele reguli. La locul de muncă păstrate curate și pentru a nu pune în locul de muncă. Asigurați-vă că pentru a nu contamina reactivii.
Ce facem cu materialul obținut:
Toate subiectele acestei secțiuni:
Datele experimentale și calculate
Dimensiunea non Date Parametru Simbol Valoare numerică de metal Greutate
Presiunea aburului saturat
Temperatura, 0C Temperatura Presiune, Presiune 0C kPa mm Hg. Art. kPa
prepararea soluției
În conformitate cu regula de cruce (pătrat Pearson), se scade cu o cantitate anume mod diagonalele predeterminat (C%), pentru a da numărul de părți în greutate de soluții stoc:
Concentrațiile de reactanți
experiențe Explicatie În experiment au studiat influența concentrației de Na2S2O3 tiosulfat de sodiu asupra vitezei de reacție: Na2S2O3 +
Datele experimentale și calculate
Tuburi Non Număr soluție Concentrație Na2S2O3 picăturile timp de reacție t, cu AEC ratei
temperatură
experiențe Explicatie În experiment au studiat efectul temperaturii asupra vitezei de reacție de tiosulfat de sodiu cu acidul sulfuric: Na2S2O3 + H2SO4
Datele experimentale și calculate
Experimente la temperatura camerei, reacția 0C timp t, cu viteza de reacție
un catalizator
Catalizatori experiență Explicatie sunt substanțe care modifică (creștere sau scădere) a ratei unei reacții chimice, dar reacția în sine rămân neschimbate.
EXPERIENTA echilibru 4. Chimice
Explicarea experiență în acest experiment au studiat deplasarea reacției de echilibru: FeCl3 + 3KCNS Û Fe (CNS) 3 + 3KCl.
date de test
Tuburi Non soluție Adaugarii (Formula substanță) slăbire sau întărire soluții de colorare echilibru direcție de deplasare (spre
XP 1. Hidroliza diferitelor tipuri de săruri
Explicație Experiența Hidroliza - reacția dintre ionii de apa sare cu ioni. În această formă de acizi și baze slabe, schimbarea pH-ului soluției. Există trei cazuri de hidroliză săruri.
electroliți puternici și slabi
Cele mai slabe Bazele Acizi de Puternic Kdiss de Puternic slab Kdiss
date de test
Formula caracteristici de bază de sare și tăria acidă, sare indicator care formează culoarea hârtiei acide, neutre sau mediu alcalin,
Experimentul 2. Compararea hidroliză și săruri acide medii
Sărurile experiență Explicație formate acizi polibazici slabi hidrolizat în trepte. În aceste săruri de adiție acidă formă. De exemplu, sărurile de hidroliză Na2CO3
Gradul de hidroliză
Explicație sare Experiența Hidroliza a format un acid slab și o bază tare, urmează schema: A + HOH Û HA + OH-. constantă de hidroliză
grad de hidroliză
Explicație sare Experiența Hidroliza formată o bază slabă și un acid tare, urmeaza schema: R + + HOH Û KOH + H +. Constantă g
EXPERIENȚA 5. Offset echilibru hidroliză
Definiții săruri de experiență formate dintr-un acid puternic și o bază slabă, o bază puternică și un acid slab, opțional hidrolizarea offset. K + HOH Û KOH +
EXPERIENTA 6. Efectul temperaturii asupra gradului de hidroliză
Conductaore Reactivi experiență: soluție de acetat de sodiu 0,2 N, CH3COONa; Indicator de fenolftaleină. Țeava de turnare 5 picături de CH3CO acetat de sodiu
XP 7. efect reciproc al sărurilor asupra gradului de hidroliză
Experiența Explicație cu dizolvarea simultană a sărurilor (de exemplu, ZnCl2), a format un acid tare și o bază slabă și o sare (de exemplu, Na2SO3), formează un
1. EXPERIENȚĂ reducerea proprietăților metalelor
Elemente de experiență Explicație electronodonor specii, adică. E. Având o energie de ionizare mic, numit metale. Bricheta atomul donează un electron, cu atât mai mare proprietățile sale metalice.
Experimentul 3. Oxidarea cation Fe2 + la Fe3 + de oxigen al aerului
Experiența Explicație oxidare mai mare a majorității metalelor este cea mai stabila. De aceea, Fe2 + cation tinde să se miște în Fe3 +. Oxidarea este efectuată în oxigen
sulfit de sodiu
Conductaore Reactivi experiență: soluție de K2Cr2O7 bicromat de potasiu 0,5 N; 0,5 N soluție de Na2S de sulfură de sodiu; 0,1 N soluție de kis sulfuric
nitrit de potasiu
Conductaore Reactivi experiență: soluție de K2Cr2O7 bicromat de potasiu 0,5 N; Soluție 0,5 N KI de iodură de potasiu; 0,1 N soluție de acid sulfuric H2
peroxid de hidrogen
Efectuarea Reactanți experiență: 3% soluție de peroxid de hidrogen H2O2; Soluție 0,5 N KI de iodură de potasiu; soluție de permanganat de potasiu 0,05 N de KMnO4;
Experiența 5.1. reacția de disproporționare de sulfit de sodiu
Efectuarea reactivi de experiență: sulfit de sodiu Na2SO3 (kr.); apă distilată; 0,5 N soluție de sulfat de cupru (II) CuSO4.
Experiența 5.2. reacția de disproporționare de peroxid de hidrogen
Efectuarea Reactanți experiență: 3% soluție de peroxid de hidrogen H2O2; soluție de potasiu Dicromat K2Cr2O7 (conc.). Tubul n
Experiența 6.2. Descompunerea dicromat de amoniu
Efectuarea reactivi de experiență: dicromat de amoniu (NH4) 2Cr2O7 kr. Se pune pinch de dicromat de amoniu (NH4) 2Cr2