Defecte în structura cristalină
In cristale reale nu există nici un aranjament perfect corectă a atomilor în întregul volum al cristalului. Există întotdeauna încălcări ale aranjament corectă a atomilor. Aceste tulburări sunt numite defecte în structura cristalină (BCS). Acestea sunt împărțite în: 1) litera; 2) linear; 3) de suprafață.
Dimensiunile punctului defectului aproape de distanța interatomică. Pentru punctul de defecte sunt posturi vacante și anunțuri intercalate. Posturi vacante numit siturile rețelei cristaline, în cazul în care nu există atomi. Chemat atom interstițial situat între zăbrele (situri de cristal Fig. 1.4).

Fig. 1.4. Punct defecte:
și - post vacant; b - posturi vacante diagrama de deplasare în cristal;
în - atom interstițial
Poziția adesea format la trecerea atomilor din situl cu zăbrele și mai puțin la suprafață, ca urmare a trecerii lor în interstițiu. defecte punctuale apar datorită mișcării termice a atomilor. La orice temperatură există întotdeauna atomii a căror energie cinetică este mai mare decât valoarea medie pentru o anumită temperatură. Acești atomi pot depăși bariera de potențial creat de atomii vecine, și ieși din site-ul dvs. la suprafață sau în spațiul interstițial. În Grile de muncă close-ambalate este mult mai mult decât intercalat care. Locuri de munca pot fi mutate cu ușurință peste cristal. Cu cât temperatura, mai numărul de posturi vacante și timpul de ședere mai puțin de un nod al grilajului. La o temperatură apropiată de punctul de topire (mp), numărul de posturi vacante pot ajunge
1% în raport cu numărul de atomi din cristal. defecte punctuale provoca o denaturare locală a rețelei cristaline [2].
Principalul tip de liniar BAC sunt dislocații. Ele sunt de margine și șurub.
cristal Mental nadrezhem perfect în decalajul inserție format suplimentar atomic semiplanul (de extra). O astfel de „pană“ denaturează rețeaua cristalină. Această distorsiune este deosebit de semnificativ la marginea suplimentare. Zona din jurul imperfecțiunilor cristaline ale marginii suplimentare se numește o TION muchie dislocare (fig. 1.5).
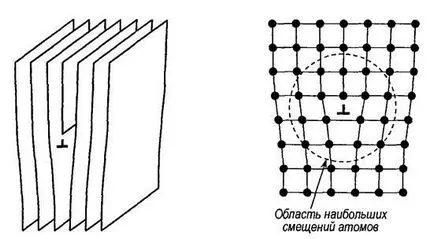
Fig. 1.5. O muchie dislocare (a) și dispunerea atomilor
în domeniul dislocării (b)
In jurul grilajului dislocare este deformată elastic. Dacă din plus la partea de sus a cristalului, dislocare se numește pozitiv și reprezintă. în cazul în care partea de jos - negativ și medie. În secțiunea transversală a cristalului în încălcarea dispunere corectă a atomilor, cauzate de dislocare, extinde la mai multe perioade grilajul și într-o direcție perpendiculară pe secțiunea transversală, pentru multe mii de distante interatomice.
Dislocarea prin aplicarea unei forțe de forfecare mică poate fi ușor de mutat. Ca urmare a deplasării suplimentare mici va intra în întregul plan al cristalului, iar funcția sa va fi de a efectua avionul vecin. Dislocările același semn se resping și de a atrage semne diferite. Dislocații care apar în procesul de cristalizare, deformare plastică etc. Ei au o mare influență asupra proprietăților metalice [2].
Densitatea dislocare este total dislocãrile lungime Sl per unitate de volum V:
La metale recoaptă r = 10 iunie ... 10 8 cm -2. După mare de plastic la rece deformare r = 10 ... 10 12 luna noiembrie cm'2. Încercarea de a crește densitatea dislocațiilor peste 10 ... 10 12 luna noiembrie cm'2 duce la fisuri si distrugeri ale metalului.
Mai ales o mare influență asupra rezistenței metalelor luxații. Atunci când o creștere semnificativă a densității de dislocare și scăderea rezistenței mobilității lor crește de mai multe ori, în comparație cu metalele recoapte [3].
Prin suprafața BCS includ: 1) limitele granulelor; 2) frontiera subzoren.
Policristalină conține un număr mare de boabe mici. Granițele boabelor sunt regiuni de tranziție în care rețeaua cristalină a boabelor cu o anumită orientare în spațiu lin în rețea cu o altă orientare grăunțe (fig. 1.6a).
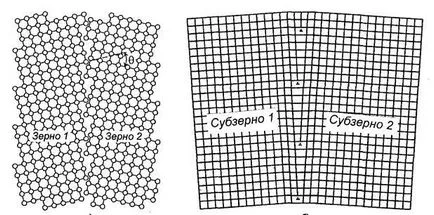
Fig. 1.6. defecte de suprafață:
și - limite de mare unghi (q - unghi misorientation);
b - limite-unghi mic
Limita dintre granulele are o lățime de 1 ... 5 nm. La încălcare dispunerea corectă delimitare a atomilor. limitele granulei de unghi înalt este numit deoarece direcțiile cristalografice pentru a forma unghiuri de granule adiacente (q), ajungând la zeci de grade.
Fiecare bob metalic include blocuri individuale sau subzoren. Subgrain face parte din cristal, în raport cu structura corectă, în care nu dislocare. limite joase unghi între subzornami reprezintă dislocații perete (fig. 1.6, b).
defecte de suprafață afectează proprietățile mecanice și fizice ale metalelor. Fine cereale, mai mare de curgere, vâscozitatea și un risc mai mic de fracturi fragile.
Aliaje - materiale care conțin cel puțin două elemente. Aliajele sunt preparate prin aliere, sinterizare, pulverizare de plasmă, electrolitică și altele asemenea Ei au o structură mai complexă. În gloriile elemente pot interacționa în mod diferit unul cu celălalt pentru a forma faze diferite. Ea numita fază omogenă parte separată a aliajului având aceeași compoziție, structură și proprietăți.
Următoarele etape pot fi formate în aliajele conform interacțiunii fizico-chimică a 1 soluții lichide); 2) soluții solide; 3) compuși chimici; 4) fazele intermediare care au atribute ca soluții solide și compuși chimici.
Soluțiile solide sunt numite faze în care atomii de un element situat în rețeaua cristalină a celuilalt element, fără a schimba tipul rețelei cristaline. Element grilă care este reținută în soluția solidă este solventul. iar celălalt - solubil.
Distinge soluție solidă de substituție (fig. 1.7, a) și introducere (1,7 lb). În formarea de soluții substitutionali solide ale atomilor elementelor dizolvate înlocuiți unele dintre atomii de solvent la situsuri cu zăbrele al rețelelor cristaline.
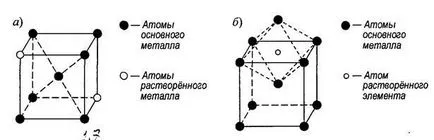
Fig. 1.7. Soluție Schema solidă de substituție (a) și introducerea (b)
Atomii elementelor dizolvate pot fi substituite pentru oricare dintre nodurile grilajului solvent. Topeste soluții de substituție formate de elementele, ale căror raze atomice diferă de cel mult 15%.
Elemente de solubilitate în soluție solidă scade odată cu creșterea diferenței în raza atomică a elementelor de aliere și valențele lor. La formarea soluțiilor solide substitutionali este posibilă și nelimitată solubilitate. Acest lucru se întâmplă atunci când, pentru orice raport dintre elementele de aliere toți atomii diferite sunt situate la nodurile zabrele spatiale generale (de exemplu, de cupru cu aur, cupru, nichel, germaniu siliciu).
Multe soluții solide substitutionali pot fi în stare ordonată, adică solventul și atomii dizolvate ocupă un anumit element din site-urile de cristal cu zăbrele. Astfel de soluții se numesc comandate sau „suprastructuri“.
În soluțiile solide, atomii interstițiale elementul solutului dispus în interstițiile, adică în pori. Astfel de soluții formează un metal de tranziție cu nemetale, având o rază mică atomic (H, N, C, B).
Introducerea unor soluții solide au întotdeauna o solubilitate limitată. Dacă solventul are un hcp sau fcc zăbrele, solubilitatea este mai mare, deoarece aceste latici porilor raza = 0,41R. unde R - raza de atomi de solvent. În rețeaua Bcc ale solubilității prin introducerea mici, deoarece dimensiunea porilor nu depășește 0,29R.
Formarea soluții solide conduce la o denaturare a rețelei cristaline, iar distorsiunea este mai mare pentru introducerea de soluții solide. Distorsionarea rețelei cristaline face aliajul mai durabil în comparație cu metalele pure, aliaje, dar menține o ductilitate suficient de mare. Soluțiile solide sunt baza pentru majoritatea aliajelor comerciale [3].
compuși chimici găsite în aliaje metalice, sunt foarte diverse. Ele se deosebesc de soluțiile solide ale următoarelor caracteristici: 1) au o structură strict definită și formula chimică Am Bn. unde A și B - elementele corespunzătoare, n și m - amorse; 2) rețeaua cristalină a unui compus diferit de grilaje componentele care formează compus; 3) proprietățile compușilor chimici sunt diferite de proprietățile elementelor constitutive; 4) au un punct de topire constant; 5) formarea unui compus chimic este însoțit de un efect termic semnificativ.
Spre deosebire de solizi compuși chimici soluții formate în mod tipic între elementele care au o mare diferență în structura atomică și laticile cristaline.
Cele mai bune proprietăți mecanice sunt acele aliaje care se bazează pe soluții solide cu suprapusă în ea fin divizate particule solide de compuși chimici, sau faze intermediare. Cu cât aceste particule din aliaj, cu cât duritatea și rezistența, dar ductilitate mai mică și tenacitate.
un metal de tranziție de la lichid la solid se numește cristalizare. În timpul cristalizării, sistemul trece la o stare mai stabilă termodinamic, cu o energie liberă mai mică. Schimbarea de energie liberă a solide și lichide FZH FTV metalului depinde de temperatura (Fig. 2.1).
T0 temperatură deasupra metalului topit mai stabil. Ea are o sursă de energie liberă mai mică și sub această temperatură este din metal dur mai rezistent. T0 temperatură se numește temperatură de echilibru de cristalizare. La această temperatură pot coexista simultan faza lichidă și solidă.
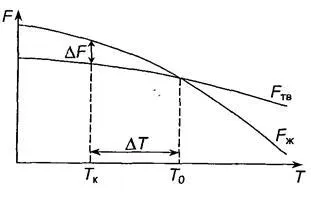
Fig. 2.1. Schimbarea energiei libere F a lichidului și solidul
cu temperatura metalului
Procesul de cristalizare la această temperatură nu a început încă. Acesta poate avea loc numai la subrăcire de metal de mai jos T0. Diferența dintre T0 temperaturi și Tc este numit gradul de subrăcire
Răcirea Curbele ce caracterizează procesul de cristalizare a metalelor pure în timpul răcirii cu rate diferite sunt prezentate în Fig. 2.2.
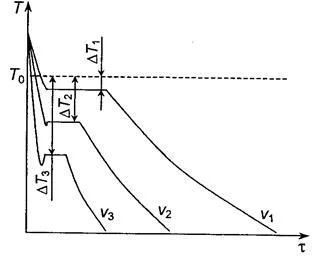
Fig. 2.2. Curbele de răcire din metal
La gradul DT răcire subrăcire foarte lentă este mică, iar procesul de cristalizare are loc la o temperatură apropiată de T0 echilibru. Odată cu creșterea ratei de răcire a crește gradul de subrăcire. Când solidificare foarte pure grad metale subrăcire poate fi mare, dar pentru pur comercial nu depășește 10 ... 30 ° C
Când temperatura de cristalizare se observă platforma (temperatura de oprire picătură) orizontală. Educația se datorează pentru a elibera căldura latentă de cristalizare.
Procesul de cristalizare incepe cu formarea fazei lichide în interiorul semințelor de cristale care sunt centre de cristalizare. Apoi, creșterea germinale.
Cel mai adesea formate în timpul cristale (arborescente) cristalizare ramificată, numite dendrite. In formarea cristalelor este dezvoltarea lor în direcția perpendiculară pe planurile de densitate maximă de ambalare a atomilor. În primul rând a format ramuri lungi, axele care sunt numite de ordinul întâi. Concomitent cu extinderea primei axe perpendiculare pe cale de a le începe să crească axa de două ori. Pe axele de ordinul al doilea cresc axa întreită, etc. Ultimul lucru este cristalizarea în regiunile dintre detrita (fig. 2.3).
Dendritele cresc la atâta timp cât nu sunt în contact unul cu celălalt. Apoi, umple spațiul mezhosnye. Dendritele sunt transformate în formă neregulată cristale, care sunt numite cristalite sau boabe.
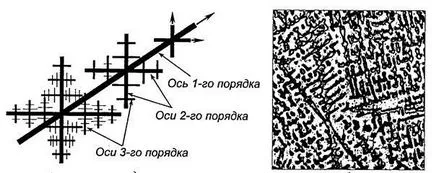
Fig. 2.3. Structura Schema dentdrita (a) și formează o structură dendritică pe o secțiune subțire (b)
Cristalizarea se caracterizează prin doi parametri: CC - număr de centre germinale, care au apărut într-o unitate de volum de metal lichid pe unitatea de timp; CP - rata de creștere, și anume, calea parcursă de fața în creștere a cristalului de pe unitatea de timp.
Embrionii pot fi formate ca un lichid în anumite cantități, iar particulele solide străine prezente în metalul lichid.
Prima metodă de formare a centrelor germinale se numește spontan. iar al doilea - nonspontaneous.
În stare lichidă, atomii muta aleatoriu din cauza mișcării termice. Dar există mici grupuri fluide de atomi cu un astfel de aranjament ca în rețeaua cristalină. Aceste grupuri sunt instabile - se dizolvă și reapar. Când răcirea bruscă mai mare dintre ele devin rezistente și capabile să crească. Aceste categorii sunt germinale centre de cristalizare atunci când spontană. Dar generarea spontană de cristale în metalul lichid este dificil.
Cele mai multe centre germinale sunt formate pe particulele solide străine prezente în metalul lichid.
Dimensiunea granulelor în timpul solidificării este determinată de raportul dintre embrioni care rezultă și rata lor de creștere. Mai mari și mai mici CC CP, mai mici, cristalele formate. Ambii parametri sunt asociați cu mișcarea atomilor și deci depinde de temperatura.
La grade scăzute de numărul de subrăcire de centre germinale nu este suficient. Structura grosier este formată prin solidificare. Odată cu creșterea gradului de subrăcire număr de centre germinale crește mai intens în comparație cu rata de creștere. Prin urmare, se obțin cristale mai mici. În consecință, o mai mare viteza de răcire în timpul cristalizării, mai fină se obține cereale. Pentru boabe mici în metalul topit administrat adesea impurități speciale. Acest proces se numește modificare [1].