Chain Reaction (Chimie)

Pentru prima dată, termenul „reacție în lanț“, a fost propus de către chimistul german și fizician Max Bodenstein. g. care în 1913 a constatat că, în unele reacții fotochimice (de exemplu, reacția hidrogenului cu clor pentru a forma acid clorhidric și clor cu monoxid de carbon pentru a forma fosgen) absorbția unui singur foton conduce la o interacțiune a sute de mii de molecule de materii prime. După cum a fost deja înțelegerea că fiecare foton absorbit este capabil doar o singură particulă, sa concluzionat că restul reacțiilor în lanț cauzate de particule active, fără implicarea ulterioară a cuante de lumină. Ca o astfel de particule active Bodenstein sugerat molecule excitate Cl2 * clor. și în 1916, un alt chimist german W. Nernst a sugerat că particulele active sunt atomice în natură. El a propus, de asemenea, un circuit serie de reacția moleculelor de clor și hidrogen (reacție în lanț neramificat):
Secvențială de circuit de transformare în care conservă particula activă (Cl • sau H •), poate implica o multime de molecule de reactivii de pornire (Cl2 și H2), în timp ce formula brută a reacției reflectă stoechiometria reacției:
Teoria reacțiilor în lanț
Semne de reacții în lanț
- Reacția este accelerată în prezența inițiatorilor, cu dezintegrarea unei molecule de inițiator conduce la conversia mai multor molecule reactante.
- Reacția este inițiată prin acțiunea radiației luminoase sau ionizante, cu un randament cuantic mai mare de 1.
- Reacția este inhibată de inhibitorii și debit inhibitor mult mai mică decât viteza de reacție neinhibate.
terminologie
O reacție în lanț are loc cu participarea centrelor active, - radicali liberi, atomi, molecule excitate, care participă într-un proces în lanț. Reacția poate conduce un situs activ (de exemplu, în cazul polimerizării radicale):
sau mai mult, de exemplu, în reacții sulfoxidation:
R ⋅ + SO 2 → RSO 2 ⋅ \ rightarrow RSO_ \ cdot >>> RSO 2 ⋅ + O 2 → RSO 4 ⋅ \ cdot + O_ \ rightarrow RSO_ \ cdot >>> RSO 4 ⋅ + RH → RSO 4 H + R ⋅ \ + RH \ rightarrow RSO_H + R \ cdot >>> inițiere (nucleaŃie) lanț cdot
Circuit Etapa de inițiere este formarea particulelor active tind să rupă legăturile chimice. Acest pas este cel mai consumatoare de energie și are loc la temperaturi ridicate, expunerea la lumină, radiații ionizante, electroni accelerați și în prezența inițiatorilor - substanțe cu materii prime o energie legătură chimică de disociere mai discontinuității energetică legătură chimică. Astfel de substanțe sunt diferitele inițiatori radicali, de exemplu, azobisizobutironitril. peroxid de benzoil. kumilgidroperoksid și alte substanțe, care are loc prin încălzirea clivajul legăturii homolitică pentru a produce radicali activi, pornind o reacție în lanț.
Reacțiile în lanț, de asemenea, pot servi inițiate procese de transfer de electroni, cum ar fi FeSO4 reactiv Fenton - H2 O2:
In contrast, catalizatorii, inițiatori sunt consumate în timpul reacției.
Circuit Continuarea cuprinde reacția cu moleculele de centre active de pornire reactanți, care produsele de reacție sunt formate și păstrate centru activ. extindere a lanțului este posibilă datorită executării principiului indestructibilitatea valență liberă în situsurile active ale interacțiunii cu moleculele valentnonasyschennymi.
Legătura în lanțul este o secvență de acte de continuare a lanțului care se termină în tipul inițial de centru activ. În cazul reacției clorului cu hidrogen, cum acționează două sulfoxidation reacție - trei.
Când circuit deschis are loc distrugerea centrului activ. Dispariția valență liberă în următoarele cazuri:
- de terminare a lanțului pătratice datorită interacțiunii dintre cele două centre active cu unul pe altul. Este necesar să se coliziune cu o a treia particulă, care transportă departe energia de reacție
- reacția cu centrul activ al moleculei, la care un radical inactiv, în imposibilitatea de a continua lanțul - de terminare a lanțului liniar omogen
- reacția cu centrul activ al suprafeței (de exemplu, vasul sau particulele solide) - de terminare a lanțului eterogen liniar:
Lungimea lanțului se numește numărul total de legături în reacțiile de extensie în lanț care au loc într-un singur radical, rezultând în circuitul de generare. Dacă β - probabilitatea de terminatori de lanț, (1-β) - probabilitatea de creștere a lanțului, lungimea lanțului de ν este:
unde vp - viteza de reacție în lanț de extensie, vt - viteza de circuit deschis. La β suficient de mare lungime a lanțului este mic, așa
Reacțiile în lanț neramificate în fiecare reacție act elementar produce un situs activ al unuia dintre centrul activ. Procesul de formare a mai multor centre active, în timpul evenimentului elementar numit ramificare reacții în lanț.
Cinetica reacțiilor în lanț neramificate
Particulele active implicate în reacția în lanț sunt destul de activi și să reacționeze rapid cu reactivii și moleculele unul față de celălalt. Ca rezultat, echilibrul dinamic de sistem se stabilește între viteza de formare a particulelor active și rata lor de moarte și concentrația de zone active R • devine cvasistaționară:
și rata de vi inițiere a catenei egală vi lor viteza de rupere:
În cazul unui lanț linear de terminare
Viteza de reacție de terminare este egală cu
și concentrația cvasistaționară a radicalilor R •
Pentru terminare a lanțului pătratică
Condiții lanțuri lungi: VP viteza lanțului este mult mai mare decât viteza de inițiere și terminare a lanțului. În acest caz, calculul concentrației de formare a siturilor active și pierderea de zone active neglijate.
Pentru reacția în lanț a clorului cu hidrogen
Exemplul de reacție în lanț neramificat - piroliza etan:
Conditii lanturi lungi:
Pe lângă toate stadiile de reacții în lanț linear caracteristic ramificat lanț de reacții au una sau mai multe etape ale lanțului de ramificare, care pot avea loc prin mecanisme diferite.
Acest tip de ramificare a observat, de exemplu, hidrogen, în reacția de ardere:
H ⋅ + O 2 → O H ⋅ + O. \ rightarrow OH \ cdot + O: >>> O. + H 2 → H O ⋅ + H ⋅ \ rightarrow HO \ cdot + H \ cdot >>> Putere ramificareObservată în cazul formării de particule de mare energie, în special în reacția hidrogenului cu fluor pentru a forma fluorura de hidrogen molecule excitate și transferul de energie de la ea la molecula de hidrogen:
Pentru reacțiile în lanț ramificat sunt caracterizate prin regimuri de echilibru și ineglae apariției sale. În prima rata de rupere caz treaptă deasupra lanțului de ramificare trepte de viteză, astfel încât concentrația cvasistationar de site-uri active la o adâncime relativ mică a constantei de reacție. Dacă rata de ramificare a lanțului depășește rata lor de rupere, concentrația de centre active în sistem crește rapid, și există o explozie în lanț. Este caracterizată prin inflamație lanț de tranziție într-o explozie termică în cazul în care eliminarea căldurii din sistem este împiedicată.
Viteza și profunzimea reacției în regim tranzitoriu exprimă frecvent ecuația Semenov:
în cazul în care φ - factor de ramificare cu lanț: diferența dintre vitezele de ramificare și de terminare a lanțului în calcul pentru un site activ. Condiții cp = 0 este limita pentru trecerea în modul inconstant.
Posibilitatea de a muta reacția în lanț ramificat de la modul staționar la tranzitoriu determinat condiții critice în care ramificarea și de terminare a lanțului sunt viteze egale. Această tranziție are loc atunci când concentrația reactanților, temperatura, mărimea vasului, și introducerea de impurități, chiar și atunci când sunt diluate cu un sistem de gaz inert.
Efectul presiunii asupra reacției în lanț ramificat în fază gazoasă modul sistem este definit de trei zone:
- Zona de joasă presiune - rata de terminare a lanțului este destul de mare, datorită difuziei centrelor active și pierderea la pereții vasului, viteza de reacție este scăzută
- Zona de creștere a presiunii - datorită difuziei este impiedicata situsurile active și rata de creștere a concentrației reactanților depășește lanțul de ramificare rată de rupere este accelerat amestecul de reacție și reacție inflamație - limita inferioară autoaprinderea
- Zona de înaltă presiune - datorită concentrației ridicate de centre active, crește proporția pătratic de reacții de terminare a lanțului în trimolecular și la o anumită presiune de reacție din nou are loc în regim staționar - limita superioară a autoaprinderea.
Cu creșterea temperaturii, regiunea de aprindere între limitele inferioare și superioare ale aprinderii se extinde din cauza crescut probabilitatea că lanțul energetic de ramificare, în timp ce o viteză de circuit deschis este schimbat ușor. Cu scăderea temperaturii, limitele inferioare și superioare ale aprinderii coaguleze într-un singur punct. Ca urmare, dependența limitelor de aprindere ale temperaturii are un aspect caracteristic, numit peninsula aprindere.
Prin acest mecanism de ramificare radicalii formați din produșii de reacție moleculare, și poate fi privit ca un sistem în care inițiatorul se acumulează, deoarece rata de dezintegrare este mult mai mică viteză de transfer de lanț. O astfel de mecanism este observată în oxidarea hidrocarburilor cu oxigenul atmosferic (autooxidare) pentru a forma hidroperoxizi:
Deoarece formarea hidroperoxidului și homolitică crește rata de reacție de descompunere - feedback pozitiv este realizat. Viteza de reacție este descrisă de ecuația
inhibiție
Inhibitorii Introducere pot întârzia în mod semnificativ procesele radicale în lanț. În ceea ce privește reacțiile de autooxidare a hidrocarburilor, prin mecanismul de acțiune al inhibitorilor sunt subdivizate în trei clase:
Inhibitori interacționează cu radicalii peroxid de
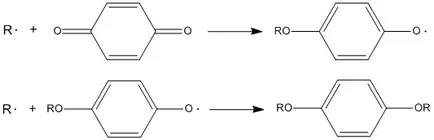
Acești inhibitori includ fenoli. amine aromatice. aminofenolilor, hidroxilamine. precum și hidrocarburi aromatice policiclice. Aceste substanțe sunt în măsură să rupă lanțul procesului de lanț 2 pentru a forma un produs de radicali și moleculare mai puțin activi:
I n H + R O 2 ⋅ → R O O H + I n ⋅ \ cdot \ rightarrow ROOH + In \ cdot >>> I n ⋅ + R O 2 ⋅ → P \ cdot \ rightarrow P >>> inhibitori, interacționând cu radicali alchil
Viteza de reacție a autooxidare hidrocarburilor crește odată cu concentrația de hidroperoxizi în ele, cu toate acestea, adăugarea substanțelor care reacționează cu hidroperoxizi (de exemplu, sulfurile disulfuri.) Pentru a forma produse moleculare procese autooxidare incetinita semnificativ:
R1 OOH + R2 S → R1 OH + R 2 SO OOH + R_S \ rightarrow R_OH + R_SO >>> R1 OOH + RSSR → R 1 OH + RS (O) SR OOH + RSSR \ rightarrow R_OH + RS ( O) SR >>>