Ce este cromatografia de afinitate, specii de cromatografie de afinitate
Cromatografia Affinity - un fel de cromatografie de adsorbție. Caracteristica principală este prezența unei cromatografiei de afinitate de complementaritate între ligandul imobilizat pe matrice și o a doua pereche partener de componente care interacționează, care se extrage din amestec cu alte substanțe care nu sunt ligand complementare. Folosind o interacțiune foarte selectivă permite un singur pas pentru a atinge un grad foarte ridicat de purificare a substanței dorite. interacțiune afin este non-covalentă și pot fi atenuate prin schimbarea pH-ului, tăria ionică, introducerea unei soluții de substanțe care previn formarea de relații complementare. Avantaje importante ale cromatografiei de afinitate sunt: selectivitate ridicată, efectul concentrației unei substanțe pe o matrice de afinitate și eliberarea enzimelor hidrolitice. Purificarea afinității poate reține adesea structura nativă veschestva.Chasche întreg ligandul este imobilizat covalent pe o matrice. Pentru a fixa o matrice ligand trebuie să fie pre-activat, adică pe suprafața particulelor purtătoare trebuie create grupări reactive. Cea mai comună metodă de activare - crearea pe suprafața unei matrice de grupări electrofile capabile să reacționeze cu grupări nucleofile ale ligandului. Procesul imobilizeze un ligand reduce la incubare cu matricea activată. Trebuie remarcat faptul că viteza de reacție depinde foarte mult de pH-ul mediului. In immunochemistry utilizat ca matrice pentru imobilizarea antigenului sau anticorp atașat la matrice. cromatografie de afinitate mișcare, în care ca un anticorp ligand imobilizat folosit este cunoscut ca cromatografia de imunoafinitate.
Una dintre cele mai comune mass-media utilizate în biochimie pentru ultimele câteva decenii, o Sepharose - special tratate perle sferice de agaroză. Există mai multe modalități de a activa Sepharose, dar metoda de activare este folosit mai des decât altele Sepharose cu bromură de cianogen (BrCN). Avantajul acestei metode este simplitatea ei, rezistență ridicată format legături stabile Sepharose într-un interval de pH destul de largă (2.0-12.0). Rigiditatea relativă și dimensiunile mari ale particulelor Sefaroza permit utilizarea unor astfel de medii în coloana cromatografică la niveluri relativ mari de hrană ale soluțiilor din coloană.
Activarea Sepharose de incubare este efectuată în soluție cu o suspensie apoasă de sefaroza bromură de cianogen. bromură de cianogen reacționează cu grupările hidroxil ale sefaroză pentru a forma imidokarbonat conținând un atom de carbon electrofil. În plus, în timpul reacției produce inactiv carbamat, care nu sunt capabile să reacționeze cu grupe laterale de acid amino nucleofil. Prin reacția cu grupări nucleofile imidokarbonata în principal cu grupări e-amino lizină, formarea proteinei covalente puternice datorită matricei prin izouree rest activat sau carbamat N-substituite (Fig. 1). Reacția cu activarea bromcian matricei se extinde doar în mediu alcalin cu separarea acidului bromhidric pentru neutralizare, care necesită adăugarea continuă de substanță alcalină la amestecul de reacție. Reacția bromcian cu matrice hidroxil este exotermă, astfel că se realizează într-o baie de gheață.
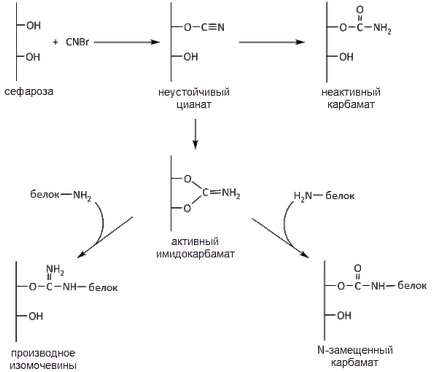
Fig. proteină de imobilizare 1. Schema pe sepharoză BrCN-activat
Trebuie remarcat faptul că nucleofile activi pe lângă grupele de e-amino ale lizinei sunt de asemenea SH-grup de cisteină și terminale grupările amino ale protein tirozin grupă OH (privind activitatea grupurilor de date sunt aranjate în ordinea următoare: SH- ˃ terminale NH2 - ˃ OH-grup de tirozină) . Pe de altă parte, tioeteri mai puțin durabile decât eterii de oxigen și ultimul inferior la puterea legăturii amidice.
Studiile imunochimice utilizând sepharose BrCN activat pregătit două tipuri de purtători - purtători cu antigeni imobilizați și mass-media cu anticorpi imobilizați. Primii au o utilizare limitată și sunt utilizate în general pentru izolarea unui ser animal imun (conținând anticorpi cu specificități diferite) pool anticorp specific numai la proteina imobilizată pe suport. Mult mai des, în practică, purtătorii cu anticorpi imobilizați. Principalele aplicații ale acestor purtători - extracție de amestecuri grosiere de macromolecule (tipic - proteine). Înalta Specificitatea anticorpului la antigenul permite un timp scurt și într-o singură etapă pentru a obține o puritate ridicată (cu o puritate de până la 95-99%) a medicamentului proteic.

Fig. 2. Instalație pentru coloane de cromatografie de imunoafinitate
Extragerea proteinei în studiu se realizează în două moduri de amestec. Origine utilizate, de obicei, pentru a obține cantități preparative de proteine, pe baza metodei de coloane de cromatografie de imunoafinitate (Figura 2). În funcție de coloana de sarcină purtătoare de afinitate umplut cu diferite diametre (de la câțiva milimetri până la metri) și au trecut prin aceste coloane soluție de proteină conținând antigenul în studiu. Cele mai multe particule purtătoare macromoleculare trece prin fără oprire, în timp ce între anticorpii imobilizați pe purtător, și un antigen conținut într-o soluție, un complex imun se formează (Fig. 3). După spălarea suportului din proteine neînrudite complexe imune este descompus prin trecerea printr-o soluție purtătoare scăzută (pH 2,0 - 4,0 pH) sau ridicată (11,0 pH - pH 12,0) valori ale pH-ului, sau soluții cu tărie ionică ridicată (2M NaCI), sau soluții care conțin un compus chaotropic (KSCN). În acest caz, proteina țintă este eluat de purtător, este colectat și transferat la stocarea optimă a soluției tampon de proteine.
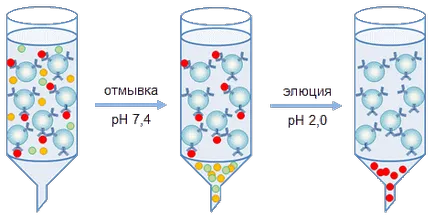
Fig. 3. Cromatografia Schema de proteine pe un mediu de afinitate.
A doua metodă de extracție a proteinei de testare dintr-un complex amestec - imunoprecipitare sau extracție în volum. Imunoprecipitarea a fost utilizat atunci când se lucrează cu cantități de substanță mici (nano- și micrograme). Volumul purtătorului de afinitate este de obicei mai puțin de o sută de microlitri, iar volumul probei test - câțiva mililitri. Aceasta este, imunoprecipitarea este utilizat în situații în care, datorită cantității mici de substanță tehnic este dificil de a crea o coloană adecvată dimensiune afinitate.
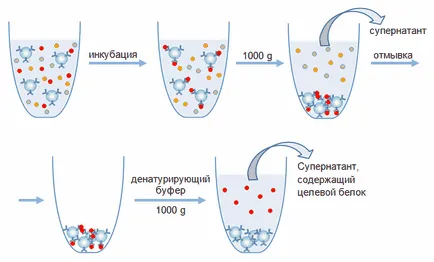
Fig. 4. Izolarea afinitate circuitului proteinelor prin imunoprecipitare.
Când se efectuează proba imunoprecipitare conținând proteina țintă, incubate timp de ceva timp (cu agitare constantă) cu particule purtător. Pe parcursul incubării, un complex imun este format, iar veniturile proteinei țintă din soluție pe particule de purtător. După aceea, suportul este precipitat, în mod tipic prin centrifugare, supernatantul a fost îndepărtat, iar complexul imun imobilizat pe particulele purtătoare distruse prin adăugarea de aceleași soluții ca și în cazul cromatografiei pe coloană (Fig. 4). De asemenea, complexul imun poate fi distrus prin SDS-tampon conținând, care este utilizat pentru prepararea probei de proteină în timpul SDS electroforeză. Acest tampon este utilizat în cazul în care planul de studiu suplimentar extras proteină folosind metoda electroforezei în condiții de denaturare, sau prin Western blotting. Cu toate acestea, atunci când se utilizează această metodă, eluarea proteinelor trebuie remarcat faptul că reutilizarea transportator devine imposibilă datorită Denaturarea anticorpilor imobilizați. În plus, eșantionul în plus față de proteina țintă va conține lanțuri ușoare și grele ale imunoglobulinelor.