Caracteristici ale legăturii peptidice
Legătura peptidică în natura lor chimică și este atașat covalent la rezistența ridicată a structurii primare a moleculei de proteină. Deoarece unitatea repetitivă a lanțului polipeptidic, și având caracteristicile specifice ale structurii, legătura peptidică afectează nu numai forma structurii primare, ci și pe un nivel mai ridicat de organizare a lanțului polipeptidic.
mare contribuție la studiul structurii unei molecule de proteină făcută L.Poling și R.Kori. Să atragă atenția asupra faptului că molecula de proteină este legături mai peptidice, ei au fost primii efectuat un studiu de difracție cu raze X minuțioase ale conexiunii. Examinat lungimile legăturilor și unghiurile prin care sunt aranjate atomi, direcția de aranjare a atomilor asupra relației. Pe baza studiilor principale următoarele caracteristici au fost stabilite legături peptidice.
1. Patru atom legătură peptidică (C, O, N, H) și două atașat
atom minciună a atomului de carbon în același plan. GrupăriRaCO- și atomii de H un carbon se află în afara acestui plan.
2. atomi de O și H ale legăturii peptidice și doi atomi de carbon, și R-grup sunt orientare relativă trans a legăturii peptidice.
3. Lungimea legăturii C-N, este egal cu 1,32 ÅAre o valoare intermediară între lungimea unei legături covalente duble (1,21 Å) Și o legătură covalentă unică (1,47 Å). Rezultă că legătura C-N este parțial caracterul nesaturat. Acest lucru creează premise pentru locul tautomere rearanjamente cu dublă legătură, pentru a forma forma enol, adică. legătură peptidică poate exista sub formă de ceto-enol.
Rotație în jurul -C = conexiunea N- dificilă și toți atomii incluși în grupul de peptide sunt configurație trans-planară. Cis-configurație este energetic mai puțin favorabilă și a găsit doar în unele peptide ciclice. Fiecare fragment de peptidă planar cuprinde două legături cu atomi de carbon capabile de rotație.
Între structura primară a proteinei și funcția sa în acest organism există cea mai apropiată legătură. Pentru a îndeplini funcția de proteină caracteristică necesită secvență specifică de aminoacizi în lanțul polipeptidic al proteinei. Această secvență de aminoacid particular, compoziția calitativă și cantitativă a (ADN → ARN → proteină) determinată genetic. Fiecare proteină este caracterizată printr-o secvență specifică de aminoacizi, înlocuirea a cel puțin un aminoacid din proteina conduce nu numai la ajustarea structurală, dar, de asemenea, la modificări ale proprietăților fizico-chimice și a funcțiilor biologice. Având o structură primară predetermină structurile ulterioare (secundare, terțiare, cuaternare). De exemplu, în eritrocite indivizilor sănătoși conține proteine-hemoglobină cu o secvență specifică de aminoacizi. Un procent mic de oameni au structuri congenitale anomalii ale hemoglobinei: hematiilor contin hemoglobina, care într-o singură poziție, în loc de acid glutamic (a încărcat, polar) conține valină aminoacizi (hidrofob, nepolar). O astfel de hemoglobină este în mod substanțial proprietățile biologice ale normale proprietăți fizico-chimice. Apariția unui aminoacid hidrofob, conduce la apariția „lipicios“ contact hidrofob (eritrocitele mișcare proastă în vasele de sânge), pentru a schimba forma eritrocitului (a semilună biconcave) și un transfer de deteriorare oxigen etc. Copiii născuți cu această anomalie, în copilărie mor din siclemie.
multe dovezi pentru afirmația că activitatea biologică determinată secvența de aminoacizi, au fost obținute după sinteza enzimei ribonucleaza artificiale (Merrifield). Polipeptidul sintetizat având aceeași secvență de aminoacizi ca enzima naturală a avut aceeași activitate enzimatică.
Cercetările din ultimele decenii au arătat că structura primară a stabilit genetic, și anume secvența de aminoacizi din catena polipeptidică este determinată de codul genetic al ADN-ului, și, la rândul său, determină structura secundară, terțiară și cuaternară a moleculei proteice și conformației sale generale. Prima proteină a cărei structură primară a fost stabilită, a fost insulina hormon proteic (care conține 51 de aminoacizi). Acest lucru a fost făcut în 1953 Frederikom Sengerom. Până în prezent, structura primară a fost rezolvată pentru mai mult de zece mii de proteine, dar este o cantitate foarte mică, dacă se consideră că natura proteinelor de aproximativ 10 12. Ca urmare a rotației libere a lanțurilor polipeptidice capabile ondulare (pliat) în diferite structuri.
Structura secundară. Sub structura secundară a moleculei proteice realiza o metodă de stabilire a unui lanț polipeptidic în spațiu. Structura secundară a moleculei de proteină formată dintr-una sau o altă formă de rotație liberă în jurul legăturile care leagă atomii de carbon în lanțul polipeptidic .żn rezultat liber lanțuri polipeptidice rotație buclă capabil (pliat) într-un spațiu în structuri diferite.
În polipeptidă naturală lanțuri sunt trei tipuri principale de structuri găsite:
Cel mai probabil, tipul structurii proteinelor globulare este considerată a fi # 945; helix Răsucirea este sensul acelor de ceasornic (viraj la dreapta spirală), care este cauzată de compoziția de acid L-amino a proteinelor naturale. Forța motrice în apariția # 945; helix este un aminoacid capacitatea de a forma legături de hidrogen. R-amino grup sunt îndreptate spre exterior față de axa centrală a-helix. dipoli> C = O și legături peptidice adiacente> N-H sunt orientate interacțiune în mod optim dipol, formând astfel un sistem extins de legături de hidrogen intermoleculare cooperative care stabilizează un helix.
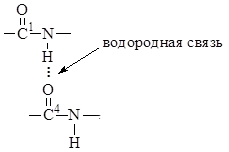
Terenul elicoidal (o rotație completă) 5.4Å 3.6 include rest de aminoacid.
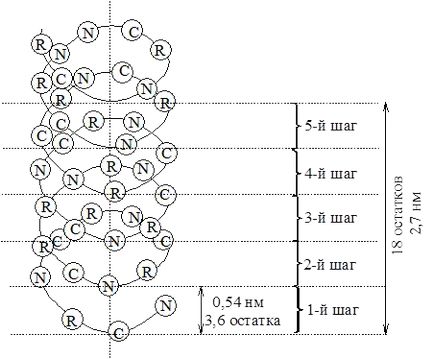
Figura 2 - Structura și parametrii unui helix proteină
Pentru fiecare proteină caracterizate printr-un anumit grad de spiralare lanțului său polipeptidic
Poate perturba structura elicoidală de doi factori:
1) în prezența reziduurilor de prolină în catenă, o structură ciclică care introduce o îndoitură în lanțul polipeptidic - nici o grupare -NH2. astfel încât este imposibil intralanț formarea legăturii de hidrogen;
2) în cazul în care lanțul polipeptidic sunt multe resturi de consecutive de aminoacizi având o sarcină pozitivă (lizină, arginină) sau încărcat negativ (glutamic, acid aspartic), în acest caz o repulsie reciprocă puternic odnoimennozaryazhennyh grupuri (-COO - sau -NN3 +) depășesc considerabil stabilizând efectul legăturilor de hidrogen din o-helix.
Un alt tip de configurație a lanțurilor polipeptidice găsite în proteine de păr, mătase, mușchi și alte proteine fibroase, numite # 946; -structures sau foaie pliată. Tipul structura foaia pliată este, de asemenea, stabilizat prin legături de hidrogen între aceleași dipolii -NH. O = C<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные
odinakovonapravlennye sau lanțuri de polipeptide antiparalele,
sunt întărite prin legături de hidrogen între lanțurile. Astfel de structuri sunt numite foi plisate-b (figura 2).
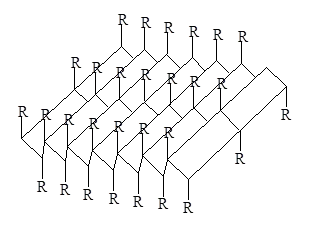
Figura 3 - b-structura lanțurilor polipeptidice
o spirală și foi pliate - sunt ordonate structură, în care există o suprapunere regulată a resturilor de aminoacizi din spațiul. Unele părți ale lanțului polipeptidic nu are nici o organizare spațială periodice regulate. acestea sunt denumite ca bobina dezordonat sau aleatoare.
Structura terțiară. Tretichnoystrukturoy în curs de a înțelege lanțul polipeptidic de ambalare în spațiul unui anumit volum.
Structura terțiară a proteinelor este formată prin plierea în continuare a unui lanț peptidic care conține porțiuni de helix, b-structură și bobină aleatoare. Structura terțiară a proteinei este formată o structură primară complet automat, predeterminate spontan și complet și are o legătură directă cu forma moleculei de proteină, care poate fi diferită de cea sferică la filiform. Forma unei molecule de proteină este caracterizată prin parametri cum ar fi gradul de asimetrie (raportul dintre axa lungă la scurt). In proteine filamentoase sau fibrilare grad de asimetrie este mai mare de 80. Dacă gradul de asimetrie este mai mică de 80 aparțin globulară proteinelor. Cele mai multe dintre ele au gradul de asimetrie a 3-5, adică, Structura terțiară este caracterizată printr-un ambalaj dens al lanțului polipeptidic, se apropie de forma de balon.
In formarea proteinelor globulare, radicali hidrofobi aminoacizi nepolari sunt grupate în interiorul moleculei de proteină, în timp ce radicalii polari sunt orientate spre apă. La un moment dat, există conformația cea mai favorabila termodinamic a moleculei este stabilă - globula. In aceasta forma, molecula de proteină este caracterizată prin cea mai mică energie liberă. La conformație globula luat naștere este influențată de factori cum ar fi pH-ul, tăria ionică a soluției, și interacțiunea moleculei de proteină cu alte substanțe.
Principala forță motrice în cazul unei structuri tridimensionale, este interacțiunea dintre radicalii de aminoacizi cu moleculele de apă.
Proteinele fibrilare. În formarea structurilor terțiare nu formează globulelor - lanțurile polipeptidice care nu sunt îndepărtate, ci rămân extinse sub formă de lanțuri liniare grupate în fibrile volokna-.
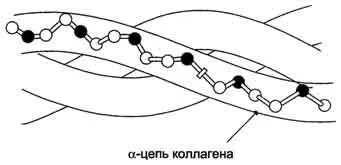
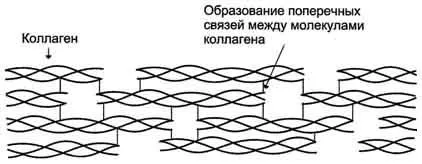
Structura Figure- fibrilelor de colagen (fragment).
Recent, există dovezi că formarea structurii terțiare nu este automată, dar este reglementată și controlată prin mecanisme moleculare speciale. Procesul implica proteine specifice - chaperone. Principalele caracteristici sunt capacitatea lor de a preveni formarea unui lanț polipeptidic nespecifici (haotic) încurcăturile dezordonate, și asigurarea furnizării (transport) la obiectivele subcelulare, crearea condițiilor pentru finalizarea coagularea moleculei de proteină.
Stabilizând structura terțiară este asigurată prin interacțiuni necovalente între catenele laterale grupe atomice.
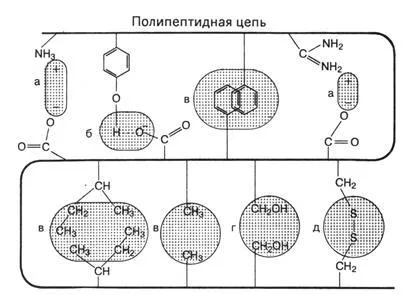
Figura 4 Tipuri de obligațiuni care stabilizează structura terțiară a proteinei
a) forțele electrostatice de atracție între radicali cu grupe ionice (oppositely încărcate interacțiune ion-ion), cum ar fi o grupare carboxil încărcată negativ (- COO -) acid aspartic și (NH3 +), încărcat pozitiv grupa e-amino a lizinei.
b) legături de hidrogen între grupările funcționale ale lanțurilor laterale. De exemplu, între gruparea OH de tirozină și aspartic oxigen carboxil al acidului
c) interacțiune hidrofobă din cauza Van der Waals dintre radicalii amino nepolari. (De exemplu, grupările
-CH3 - alanină, valină, etc ..
d) interacțiuni dipol-dipol
d) legături disulfurice (-S-S-) între cisteine. Această relație este foarte puternică și nu sunt prezente în toate proteinele. Un rol important în acest sens este jucat de substanțele proteice din grâu și făină, ca Aceasta afectează calitatea glutenului, proprietățile structurale și mecanice ale aluatului și, astfel, calitatea produselor finite - pâine, etc.
Proteinele globulare nu este o structură perfect rigidă: în culoarele cunoscute, lanțul peptidic reversibil părțile în mișcare una față de cealaltă, cu un decalaj de o cantitate mică de legături slabe și formarea unora noi. Molecule cum respiră, pulsează în diferite părți sale. Aceste ondulații nu violează planul de bază al conformației moleculei, similară cu fluctuațiile termice ale atomilor în cristal nu modifică structura cristalină dacă temperatura nu este atât de mare încât se produce topirea.
Numai după achiziție a moleculei de proteină, structura naturală, nativă terțiară, acesta prezintă activitatea funcțională specifică: catalizator, hormon, antigen, etc. Este formarea structurii terțiare este formarea de centre active ale centrelor enzimelor responsabile pentru încorporarea unei proteine complex multienzimatic, centre responsabile pentru structurile nadmolekulyanyh de auto-asamblare. Prin urmare, orice impact (termică, fizice, mecanice, chimice), ceea ce duce la distrugerea conformația proteinelor native (obligațiuni break) este însoțită de o pierdere parțială sau totală a proprietăților biologice ale proteinei.
Studiu structuri chimice complete ale unor proteine au arătat că structura lor terțiară zona în care radicalii concentrați aminoacizi hidrofobi, și un lanț polipeptidic de fapt înfășurat în jurul unui miez hidrofob identificat. Mai mult decât atât, în unele cazuri, din molecula de proteină segrega două sau chiar trei dintre miez hidrofob, care are ca rezultat o structură de 2 sau 3-nuclear. Acest tip de structură moleculară tipică pentru mai multe proteine cu funcție catalitică (ribonucleaza, lizozimul, etc.). parte separată sau regiune a unei molecule de proteină are un anumit grad de autonomie structurală și funcțională se numește un domeniu. Un număr de enzime, de exemplu, izolarea domeniilor substrat de legare și legare coenzima.
Biologic proteine fibrilare joaca un rol foarte important legat de anatomia și fiziologia animalelor. In vertebrate, ponderea acestor proteine reprezinta 1/3 din conținutul total. Exemplele fibrilyarnyh proteine de mătase pot servi ca proteine - fibroină, care constă din mai multe lanțuri antiparalele cu structura foii pliate. A-keratina proteină cuprinde între 3-7 lanțuri. Colagenul are o structură complexă, în care lanțurile 3 sunt împreună pentru a forma un dextrogir triplu helix aceeași răsucită levo. Acest triplu helix este stabilizat prin numeroase legături de hidrogen intermoleculare. Prezența aminoacizilor precum hidroxiprolina și hidroxilizina contribuie, de asemenea, la formarea de legături de hidrogen care stabilizează structura triplu helix. Toate proteinele fibrilare sunt slab solubili sau complet insolubil în apă, ca în compoziția lor conține o mulțime de aminoacizi care conțin hidrofobe, insolubile în apă izoleucina R-grup, fenilalanină, valină, alanină, metionină. După un tratament special un colagen insolubil și indigestible convertit în amestec solubil în gelatină de polipeptide, care sunt apoi utilizate în industria alimentară.
proteine globulare. Efectuați o varietate de funcții biologice. Acestea îndeplinesc o funcție de transport, și anume, transporta nutrienti, ioni anorganici, lipide etc. Această clasă de proteine aparțin hormonilor, precum și componente ale membranelor și ribozomi. Toate enzimele sunt de asemenea proteine globulare.
Structura cuaternară. Proteinele care conțin două sau mai multe lanțuri polipeptidice numite proteine oligomere. acestea sunt caracterizate prin prezența structurii cuaternare.
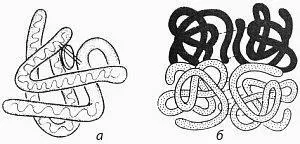
Desen - Scheme terțiare (a) și cuaternare (b) structurile proteice
Proteina oligomeric de lanțuri de polipeptide, fiecare caracterizat prin primară, structura secundară și terțiară, și se numește protomers sau lanț polipeptidic subunitatea (protomers) în astfel de proteine pot fi fie identice sau diferite. proteine numite oligomerice omogene dacă acestea sunt identice protomers eterogene și dacă acestea sunt protomers diferite. De exemplu, proteina de hemoglobină constând din 4 lanțuri: doi -a -B doi protomers. A-amilază enzimă este compusă din 2 lanțuri polipeptidice identice. Sub structura cuaternară înțeleagă dispunerea lanțurilor polipeptidice (protomers) în raport unul cu altul, adică, mod de a stivuirea lor comună și ambalare. Astfel, protomers reacționează unul cu celălalt nu la nici o parte a suprafeței sale, și o porțiune anumită (suprafață de contact). Suprafețele de contact au dispunerea grupurilor atomice, între care sunt hidrogen, legături ionice, hidrofobe. Mai mult decât atât, protomers geometrie facilitează, de asemenea, conexiunea lor. Protomers se potrivesc împreună ca un sistem de blocare și o cheie. Astfel de suprafețe sunt numite complementare. Fiecare protomer reacționează cu altul într-o multitudine de puncte, acest lucru conduce la faptul că legătura cu alte lanțuri de polipeptide sau proteine imposibile. O astfel de interacțiune complementară de molecule sunt baza tuturor proceselor biochimice din organism.