Calcularea variației energiei a unei reacții chimice la temperatură standard Gibbs
Calcularea modificărilor energetice Gibbs reacție chimică, la temperatură standard (298 K) poate fi efectuată cu datele de referință corespunzătoare pentru variații ale potențialelor standard ale formării substanțelor
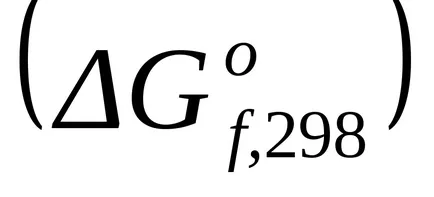
Standard Schimbarea energiei Gibbs în formarea unor substanțe simple, stabile la zero.
O altă metodă de calcul a variației standard a energiei Gibbs reacției chimice este utilizarea ecuației Gibbs-Helmholtz:
unde T = 298 K;
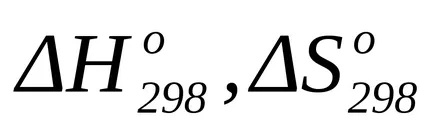
Calculul schimbării energiei Gibbs unei reacții chimice la o temperatură non-standard,
Calcularea Gibbs modificări libere energetice ale unei reacții chimice la o temperatură de obicei produc neregulat peste ecuația Gibbs-Helmholtz:
unde T - temperatura de reacție;
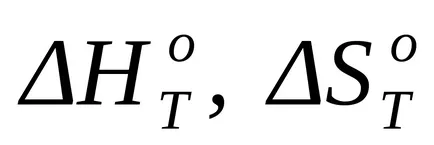
Când calcule aproximative pot utiliza ipoteza că modificările entalpiei și entropiei sunt independente de temperatură, iar calculele se aplică valorile implicite și rezultatele pentru temperatura 298K:
unde T - temperatura de reacție, pentru care se efectuează calculul aproximativ.
In absenta tranzițiilor de fază pentru calcularea corectă a standardului schimbării energiei Gibbs la o temperatură T (
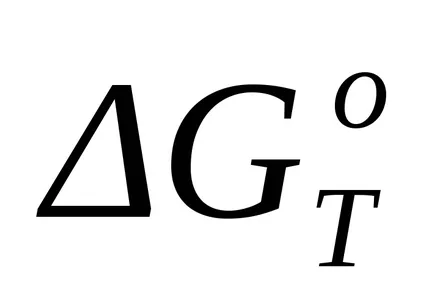
unde T - temperatura la care are loc reacția; AA, Δb, Δc, Δc - coeficienții puterilor de T obținute prin calcularea ΔSP corespunzătoare; Mo, M1, M2, M2 - coeficienții AA, Δb, Δc, Δc respectiv, la temperaturi predeterminate sunt prezentate în manuale pentru metoda de calcul specificată.
EXEMPLU Exemplul 1.15. Se calculează schimbarea aproximativă și exactă a energiei Gibbs reacției chimice la T = 298 K și T = 1800 K și pentru a determina posibilitatea apariției sale la temperaturile indicate:
datele de referință necesare sunt prezentate în tabelul. 1.10.
Este un efect termic standard schimbarea entalpie de cunoscute căldurile de formare cu formula (1,17):
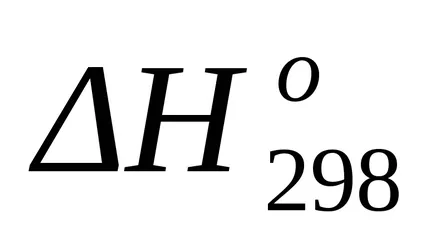
Standardul Schimbarea entropie din formula (1.38):
Schimbarea standard de energie Gibbs la T = 298 K pe descoperirea
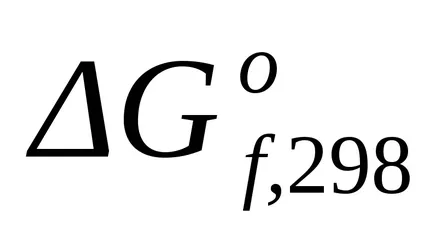
standardul Schimbarea energiei Gibbs la T = 298 K au fost calculate conform ecuației (1.43):
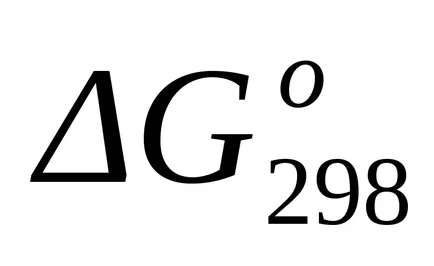
Standard Schimbarea de energie Gibbs la T = 1800 K găsi formula aproximativă (1.46):

Deoarece la temperaturi de 298 K și 1800 K
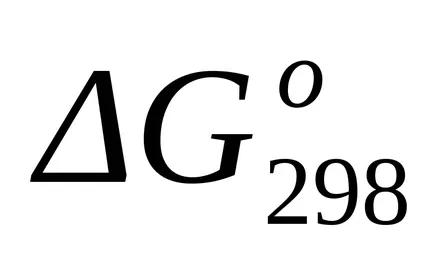
Calculul exact
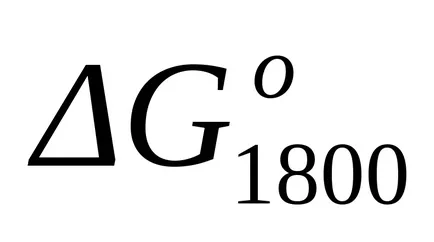
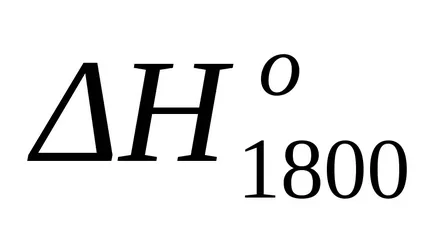
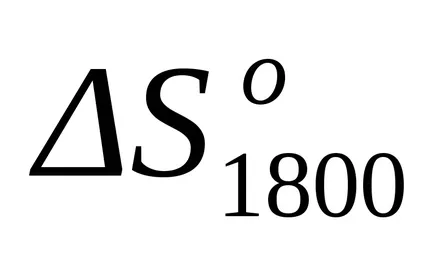
= AA (25,02 + 2 x 30.00) - (62,86 + 2 x 27.28) = - 32,40;
schimbări de capacitate termică ecuație în funcție de temperatură, după înlocuirea valorilor constatate AA, Δb, Δc va avea forma:
După înlocuirea acestei ecuații în formula (1.25) și (1.39) calculează modificări ale entalpiei și schimbări de entropie pentru reacția la T = 1800:

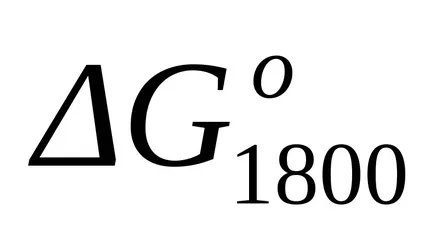
Având în vedere că valoarea rezultatelor Gibbs schimbare de energie
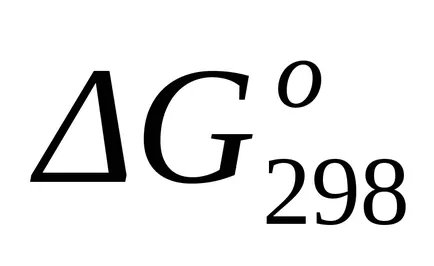
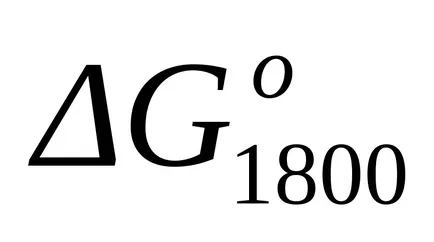
EXEMPLU Exemplul 1.16. Se calculează variația energiei libere Gibbs a reacției chimice din Exemplul 1.15 la T = 1800 K prin metoda de Temkin-Shvartsman.
Calculul se realizează în conformitate cu formula (1.47), cu referire la această reacție, în care toți participanții sunt substanțe anorganice:
Valorile Mn sunt preluate de coeficienți de referință la o temperatură predeterminată 1800 K:
valoare
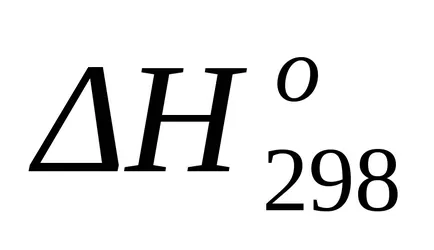
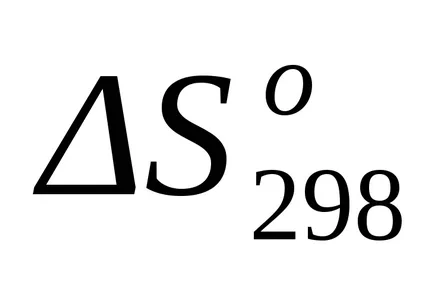
Găsim schimbarea în energia Gibbs a reacției la T = 1800 K: