Adsorbtia - componentele sistemului de redistribuire a proceselor spontane între suprafața
pot să apară în sisteme multicomponente și în redistribuirea stratului de suprafață Adsorbția ia componenta care reduce puternic tensiunea superficială. Într-un sistem monocomponent, formarea stratului de suprafață al unei schimbări în structura sa - sigiliul, care se numește avtoadsorbtsiey.
În general, adsorbția poate avea loc nu numai din cauza dorinței de a reduce energia de suprafață, dar, de asemenea, din cauza reacției chimice cu componentele suprafeței substanței. În acest caz, energia de suprafață poate crește chiar și din cauza mai redus de energie a întregului sistem.
Substanța, pe a cărui suprafață se produce adsorbția se numește adsorbant. o substanță care este redistribuit - adsorbat.
Procesul invers de tranziție a unei substanțe de la suprafață la volumul fazei - desorbție.
În funcție de starea de agregare a fazelor sunt adsorbție a gazelor pe disting adsorbanți solizi, un solid - lichid, lichid - lichid, lichid - gaz. două cantități sunt utilizate pentru a cuantifica adsorbție:
1) adsorbție specifică - cantitatea de adsorbat, pe unitatea de suprafață a adsorbantului:
,
unde n - numărul de moli de substanță în soluție;
B - suprafață;
CB - concentrația de adsorbat în stratul de suprafață;
h - grosimea stratului.
2) Valoarea determinată de un exces de substanță în stratul de suprafață pe o unitate de suprafață sau greutatea adsorbantului, numită adsorbției Gibbs sau excesivă (T).
,
unde CB, CV - concentrația de adsorbat în stratul de suprafață și în cea mai mare parte;

A prezentat un sistem de echilibru cu două faze, component distribuit este adsorbită la interfața. Granițele fazelor în metoda „grosimea stratului finit“ A. :? Xb și xB o. xB b. Limitele stratului de suprafață la o xB xB b. Numărul total de moli de componente distribuite:
. în care 1 și 2- termeni - numărul de moli de adsorbat, în faze, fără un strat de suprafață; A 3 - numărul de moli de adsorbat, în stratul interfaciale. Apoi, numărul total de moli de adsorbatul:
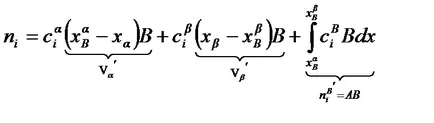
Atunci când se utilizează metoda de cantități în exces Gibbs. în care 1 și termenii 2a - numărul de moli de adsorbat, în fazele, inclusiv porțiunea stratului de suprafață cu concentrații concentrații egale în ecran; 3a termen - un număr mare de moli de adsorbat, care se încadrează pe suprafața de separare a cărei abscisă xB.
Reprezentând numărul mare de moli de adsorbat, B ni prin concentrația medie în stratul de suprafață (presupunând că constantă pe toată grosimea stratului de suprafață) după integrarea obține. unde B Va și Vb B - părți de volum ale stratului de suprafață din faza a respectiv, și b.
Pentru valoarea adsorbției Gibbs:
Dacă adsorbatul nu trece în sfera uneia dintre fazele (adsorbție pe adsorbanți solide), ecuația devine :. unde V B - cantitatea stratului de suprafață; ci - concentrația adsaorbatelor în cea mai mare parte.
Pentru rapoarte A și D formează ecuația echilibru în raport cu numărul de moli de adsorbat, în stratul de suprafață :. unde B Va și Vb B - părți de volum ale stratului de suprafață din faza a respectiv, și b, ci V B - numărul de moli de adsorbat, în stratul de suprafață, fără exces.
Aici. unde h - grosimea stratului de suprafață.
Aceste ecuații reflectă semnificația fizică a A și D, dar acestea nu pot fi utilizate pentru a determina cantitatea de adsorbție, deoarece volum necunoscut și grosimea stratului de suprafață.
Pentru a obține ecuația echilibru raportul compoziției necesare pentru numărul de moli de adsorbat, în întregul sistem înainte și după adsorbție. unde V și V v - volumul total al sistemului și cantitatea de fază fără strat de suprafață; C0 - concentrația inițială a componentului i-lea.
Eliminarea numărului de moli de adsorbat, în stratul de suprafață. substitut. obținem:
Figura Cantitatea A - întreaga zonă umbrită de sub curba concentrației în profilul stratului de suprafață, iar valoarea T este pătrată cu dublă hasura.
La stabilirea adsorbție echilibre în cantitatea adsorbită în stratul de suprafață este dependentă de concentrația sau presiunea parțială a acestei componente în cantitatea și temperatura. Conform regula fazei Gibbs, numărul de parametri care definesc starea sistemului este egal (unde F - grade de libertate, K - numărul de componente ale sistemului, F - numărul de faze 2 - doi parametri - presiune și temperatură).
În adsorbție a sistemului în fază gazoasă constă dintr-un adsorbant și gaz adsorbatul Þ K = 2, P = 2, F = 2. Este posibil să se schimbe în mod arbitrar doi parametri P și T pentru ca sistemul să ajungă la echilibru.
Pentru faza de condensat (solide și lichide) K = 3 (solut adsorbit). Presiunea în acest caz este neglijată Þ F = 2: și cu T.
T. arr. oricare dintre parametrii sistemului este determinat în mod unic de cel puțin doi parametri, adică, . [3]
Tipuri de adsorbție în funcție de parametrii de sistem