Activitatea practică № 3 p
1) Prepararea de amoniac și dizolvare în apă
a) Acțiuni. se toarnă amestecul
într-un tub de testare. Închiderea tubului de ventilare al cărui capăt este îndreptată în sus. Se încălzește până amestecul. Observații. Mirosul de amoniac. Ecuația de reacție:
Concluzii: Amoniacul poate fi preparat prin încălzirea unui amestec de săruri de amoniu și alcaline. b) acțiuni. După ceva timp flaconul cu amoniac, fără a transforma, închide tubul și apoi picătură în matrița cu apă și deschide dopul. Observații. Apa umple tubul. Ecuația de reacție:
Concluzii: Amoniacul este foarte forme solubile
c) acțiuni. Soluția rezultată a fost pus hârtie de turnesol roșie. S-a adăugat la o soluție de fenolftaleină. Observații. Lucrarea devine albastră; fenolftaleina roz. Ecuația de reacție:
Concluzie: hidroxid de amoniu are proprietăți acide bazice.
2) Arderea amoniacului în oxigen
Acțiuni. Se încălzește amestecul de
apoi prin așchie aprinde gaz evacuat dintr-un tub de evacuare a gazelor. Observații. Gaz aprins flacără puternică. Ecuația de reacție:
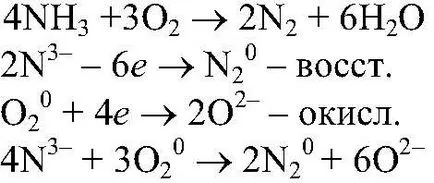
Concluzii: După cum se formează un rezultat al arderii azotului amoniac și apă. Amoniacul are proprietăți de reducere.
3) reacția amoniacului cu un acid
Acțiuni. Tubul cu amestecul se încălzește. introducerea Secvențial tubul de vapori la tuburile cu acizi concentrați
fără a atinge suprafața acizilor. Observații. Se pare că „fum alb“. Ecuația de reacție:
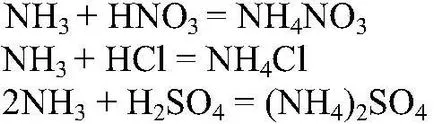
Concluzii: Amoniacul reacționează cu acizi, baze care arată. insule de comunicare.
4) Proprietăți de amoniac apos
a) Acțiuni. amoniac introductiv omită hârtie de turnesol roșie. Observații: Hârtia devine albastru. Ecuația de reacție:
Concluzii: apoși rr amoniac are proprietăți bazice. b) acțiuni. Pentru un amoniac p-py apos adăuga observații fenolftaleină. Solutia este roz. Ecuația de reacție:
Concluzii: ionii de amoniac sunt prezenți
c) acțiuni. Adăugați acid clorhidric diluat. Observații. Soluția s-a decolorat. Ecuația de reacție:
Concluzii. Soluție apoasă de amoniac are proprietăți bazice.