abur saturat
Subiecte codificator examen. umiditate pereche saturate și nesaturate.
În cazul în care un pahar de laborator deschis de apă rămasă pentru o lungă perioadă de timp, în cele din urmă apa se va evapora complet. Pentru a fi exact - se va evapora. Care este evaporarea și de ce se întâmplă?
La această temperatură, moleculele de lichid au viteze diferite. Viteza de cele mai multe molecule sunt aproape o anumita valoare medie (caracteristică pentru această temperatură). Dar, dincolo de viteze cu molecule semnificativ diferite fata de media din ambele părți mai mici și mai mari.
Fig. 1 ilustrează un grafic ilustrativ al moleculelor ale vitezei de distribuție a lichidului. fundal albastru arata foarte cele mai multe dintre molecule, viteza de care sunt grupate în jurul valorii medii. Red „coada“ grafica - un număr mic de molecule „rapid“, ale căror viteze sunt substanțial mai mari decât viteza medie a moleculelor de fluid în vrac.
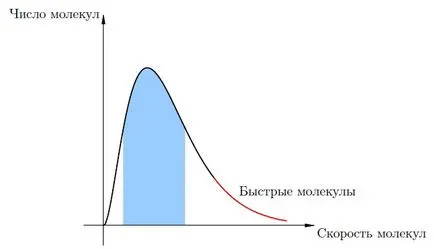
Fig. 1. Distribuția vitezei
Atunci când o astfel de moleculă ar fi destul de rapid pe suprafața liberă a lichidului (adică, la limita de lichid și aer în această secțiune), energia cinetică a moleculei poate fi suficientă pentru a se asigura că depășirea forțele de atracție și alte molecule pentru a acoperi din lichid. Acest proces este evaporare. și moleculele lăsate perechile în formă lichidă.
Astfel, evaporare - un fluid în proces de conversie cu abur are loc la suprafața liberă a lichidului (fluid în condiții speciale de conversie la abur poate avea loc pe parcursul întregului volum de lichid Acest procedeu este bine cunoscut pentru tine -. Se fierbe).
Se poate întâmpla ca, după ceva timp o moleculă de vapori se întoarce înapoi la un lichid.
Procesul de tranziție a moleculelor de abur în lichid se numește condensare. Condensarea aburului - procesul invers pentru evaporarea lichidului.
Și ce s-ar întâmpla dacă un vas cu lichid închis ermetic? Densitatea vaporilor deasupra suprafeței lichidului va începe să crească; particule de abur toate vor interfera puternic cu alte molecule de lichid zbura, iar rata de evaporare va scădea. În același timp, începe să crească rata de condensare, deoarece numărul de creșterea concentrației de vapori de molecule, revenind la lichid, acesta va deveni tot mai mult.
În cele din urmă, la un moment dat, rata de condensare va fi egală cu rata de evaporare. Va veni un echilibru dinamic între lichid și vapori: pe unitatea de timp a lichidului va decola același număr de molecule, cât de mult este returnat la vaporii. Pornind de la acest moment cantitatea de lichid încetează să scadă, iar cantitatea de abur - în creștere; cupluri ajunge la „saturație“.
abur saturat - este aburul care este în echilibru dinamic cu lichidul său. Pr nu a atins starea de echilibru dinamic cu lichidul, numit nesaturat.
Presiunea și densitatea aburului saturat și notat. Evident, și - o presiune maximă și densitate, ceea ce poate avea un vapori la o temperatură dată. Cu alte cuvinte, presiunea și densitatea presiunii vaporilor saturați depășește întotdeauna densitatea vaporilor nesaturați.
Se pare că starea de vapori saturați (ca nesaturate - chiar mai mult), poate fi descrisă aproximativ prin ecuația de stare de gaz ideal (ecuația Mendeleev - Clapeyron). În special, avem o relație aproximativă între presiunea de vapori saturați și densitate:
Acesta este un fapt foarte surprinzător, confirmat de experiment. La urma urmelor, proprietățile sale, aburul saturat este substanțial diferit de gazul ideal. Am enumera cele mai importante dintre aceste diferențe.
1. La o temperatură constantă a densității vaporilor saturați este independent de volumul său.
Dacă, de exemplu, abur saturat comprima izoterm, apoi densitatea la prima creștere, rata de condensare depășește viteza de evaporare, și o parte din aburul condensează în lichid - atâta timp cât nu din nou apar echilibru dinamic, în care vaporii de densitate revine la valoarea sa anterioară .
In mod similar, în expansiune izotermă densitatea vaporilor saturați la primele scăderi (vapori devine nesaturat), viteza de evaporare depășește viteza de condensare și lichidul se evaporă în continuare până la o dată până la echilibru dinamic nu este stabilit - și anume din nou, până când aburul este saturat cu aceeași valoare de densitate.
2. Presiunea de vapori saturați este independentă de volumul său.
Acest lucru rezultă din faptul că densitatea vaporilor nu depinde de volumul și presiunea este în mod unic asociat ecuației de densitate (1).
După cum vom vedea, legea lui Boyle - Mariotte, este valabil pentru gazele ideale, aburul saturat nu se realizează. Acest lucru nu este surprinzător - la urma urmei este derivat din ecuația Mendeleev - Clapeyron presupunând că masa gazului rămâne constantă.
3. Cu un volum constant de vapori saturați crește densitatea cu creșterea temperaturii și scade odată cu scăderea temperaturii.
Într-adevăr, creșterea temperaturii crește viteza de evaporare a lichidului.
echilibru dinamic este perturbat la un prim punct, și există evaporarea suplimentară a lichidului. Perechea va fi adăugat atâta timp cât echilibrul dinamic este readus din nou.
În mod similar, pe măsură ce temperatura scade rata de evaporare a lichidului devine mai mică, iar unele dintre aburul condensează până la restabilirea echilibrului dinamic - dar cu o cantitate mai mică de abur.
Astfel, pentru încălzire izocoră sau a vaporilor de răcire își schimbă masa, deci legea lui Charles, în acest caz, nu funcționează. dependența saturată de temperatură a presiunii vaporilor nu mai este o funcție liniară.
4. presiunea de vapori crește cu temperatură mai rapid decât liniar.
De fapt, cu o creștere a temperaturii crește densitatea vaporilor, și în conformitate cu ecuația (1), presiunea este proporțională cu produsul densității de temperatură.
Dependența presiunii de vapori cu temperatură este exponențială (Fig. 2). Ea este reprezentată de secțiunea 1-2 program. Această relație nu poate fi dedusă din legea gazului ideal.
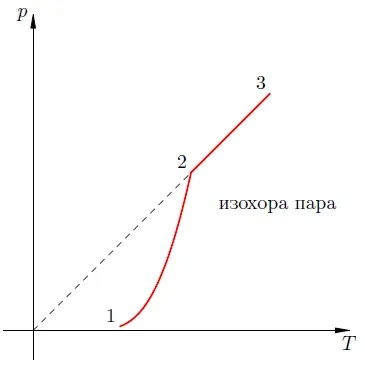
Fig. 2. Dependența presiunii vaporilor de temperatură
La punctul 2, toate evaporează lichide; la temperaturi mai ridicate, aburul devine nesaturat, și sa crește presiunea liniar la legea lui Charles (lot 2-3).
Să ne amintim că creșterea liniară ideală a presiunii gazului datorită creșterii moleculelor de șoc intensitate pe peretele vasului. În cazul încălzirii vaporilor de molecule încep să bată nu doar mai puternic, dar cel mai adesea - pentru că perechea devine mai mare. acțiunea simultană a acestor doi factori se numește creșterea exponențială a presiunii de vapori saturați.
Aerul ce conține vaporii de apă se numește .chem umed mai mare de vapori în aer, cu cât umiditatea.
Umiditatea - este presiunea parțială a vaporilor de apă în aer (de exemplu, presiunea pe care vaporii de apă să fie furnizate de ea însăși, în absența altor gaze ..). Uneori numit umiditatea absolută ca densitatea de vapori de apă în aer.
Umiditatea relativă a aerului - raportul dintre presiunea parțială a vaporilor de apă în ea o presiune de vapori de apă saturați la aceeași temperatură. De obicei, acest raport este exprimat în procente:
Din ecuația ecuația Mendeleev-Clapeyron (1), că raportul presiunii de vapori este raportul dintre densitățile. Deoarece ecuația în sine (1). Recall descrie abur saturat doar aproximativ, avem relația aproximativă:
Unul dintre dispozitivele care măsoară umiditatea, un Psihrometru. Acesta include două termometre, dintre care un rezervor este înfășurat într-o cârpă umedă. Mai scăzut conținutul de umiditate, cu atât mai intensă evaporarea apei merge din țesut, cu atât mai mare rezervorul de răcire termometrul „umed“, iar cea mai mare diferența dintre citirile și citirile temperaturii sale cu bulb uscat. Prin această diferență, cu o umiditate determinată specială de masă psychrometrica.
Sunați-ne: 8 (800) 775-06-82 (apel gratuit în România) +7 (495) 984-09-27 (apel gratuit de la Moscova)
Sau faceți clic pe „Aflați mai multe“ pentru a completa formularul de contact. Vă vom suna cu siguranță înapoi.