Unele alcaline - studopediya
hidroxid de sodiu, hidroxid de sodiu - solid alb, higroscopic și delicvescente cu toate acestea; Se dizolvă ușor în apă, în care este generată căldura. O soluție de hidroxid de sodiu în apă cu săpun la atingere și foarte coroziv. El mănâncă departe la piele, tesatura, hârtie și alte materiale. Pentru această proprietate, hidroxid de sodiu a fost numit sodă caustică. Cu hidroxid de sodiu și soluțiile sale trebuie să fie manipulate cu grijă, de teama că nu cad pe haine, pantofi, și chiar și cu atât mai mult în mâini și pe față. Pe pielea substanței au format o lungă perioadă de timp vindecarea rănilor. NaOH este utilizat în săpun de luare, piele și industria farmaceutică.
Concentrația de hidroxid de potasiu este de asemenea un solid alb, ușor solubil în apă, eliberând cantități mari de căldură. O soluție de hidroxid de potasiu ca hidroxid de sodiu, mylok la atingere și foarte consumator. De aceea, hidroxidul de potasiu, de asemenea, numit potasă caustică. Este folosit ca aditiv în fabricarea săpunurilor, sticlă refractară.
Hidroxid de calciu Ca (OH) 2 sau var stins, - pulbere albă fărâmicioasă, puțin solubil în apă (solubilitate în tabelul de Ca (OH) o formula este litera M, ceea ce înseamnă că substanța malorastvorpmoe). Acesta este obținut prin reacția rapidă var CaO cu apă. Acest proces se numește stingere. Hidroxidul de calciu este utilizat în construcția de zidărie și tencuială la pereți, pentru arbori Ceruza pentru albire, care este un dezinfectant. Soluție transparentă de hidroxid de calciu se numește apă de var. Când CO2 este trecut prin apa de var este tulbure. Această experiență are rolul de a detecta dioxid de carbon. Reacțiile în care recunosc anumite substanțe chimice numite reacții calitative.
De asemenea, există substanțe alcaline de reacție calitativă utilizând soluții alcaline, care pot fi recunoscute, printre alte soluții substanțe. Această reacție de substanțe alcaline cu substanțe speciale - indicatori (LAT „indicii“.). În cazul în care o soluție de substanță alcalină se adaugă câteva picături de soluție de indicator, atunci se va schimba culoarea (tab. 4).
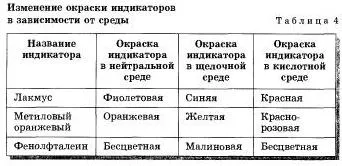
Tabelul 4 prezintă LED-urile și indicate schimbă culoarea într-un mediu alcalin și în mediu acid.
1. Motive - sunt substanțe complexe formate din ioni metalici și ioni de hidroxid. Exemple de baze cu formula: KOH, Mg (OH) 2.
2. Motivele sunt odnokislotnye și mnogokislotnye. Odnokislotnye - o bază, în formulele care indică un ion hidroxid: KOH, NaOH. Mnogokislotnye - o bază, în formulele care doi sau mai mulți ioni de hidroxid: Ca (OH) 2. 3. Toate bază - solide. Prin urmare, acestea nu sunt împărtășite de starea de agregare și solubilitate în apă. Pe această bază, baza este împărțit în două grupuri - baze solubile și insolubile. 4. (numite baze) solubile. Aceste baze formeaza metale principale grupa grupa I - Li, Na, K, Rb, Cs, Fr (aceste metale sunt numite alcaline), precum și anumite metale principale grupa II grup - Ca, Sr, Ba (aceste metale sunt numite alcalino-pamantos). Toate bazele cu excepția soluție de amoniac în apă, sunt materiale solide având culori diferite. De exemplu, hidroxidul de calciu Ca (OH) 2 este de culoare albă, hidroxid de cupru, cupru (II), Cu (OH) 2 albastru, hidroxid de nichel (II) Ni (OH) 2 verde, hidroxid de fier (III) Fe (OH) 3 roșu- culoare maro, și așa mai departe. soluție d.Vodny de amoniac NH3 * H2O, spre deosebire de alte baze nu conține un complex cation metalic și un cation de amoniu încărcat individual NH4 și există numai în soluție (această soluție este cunoscută sub numele de tine amoniac). Este ușor de descompus în amoniac și apă:
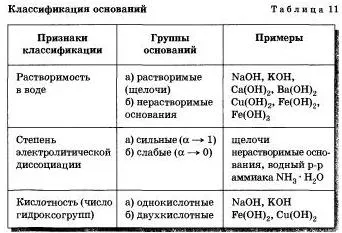
Motive de separare în grupuri de diferite caracteristici sunt prezentate în Tabelul 11.
Toate bază și prima forma de bază (electroliți puternici) în disocierea ionilor de hidroxid OH-, care sunt responsabile pentru o serie de proprietăți comune: atingere, de formare a spumei indicatori schimbare a culorii (turnesol, fenolftaleină și portocaliu de metil), reacționează cu alte substanțe.