Teoria moleculară-cinetică a gazelor ideale
Teoria moleculară-cinetică a gazelor ideale
Pagina 1 din 3
2. Bazele fizicii moleculare și termodinamică
2. Se determină numărul de atomi de N per 1 kg greutate de hidrogen și un atom de hidrogen.

3. Într-o capacitate vas închis de 20 de litri de hidrogen sunt o masă de 6 grame și o masă de heliu a fost definită la 12: 1) de presiune; 2) greutatea molară a amestecului gazos în vas, în cazul în care temperatura amestecului T = 300 K.

4. Se determină densitatea unui amestec de masa de hidrogen gazos m1 = 8g și oxigen m2 = 64 g la o temperatură T = 290 K și la o presiune de 0,1 MPa. Gaze considerate ideale.

5. capacitatea rezervorului este de 15 litri, sub presiune de azot de 100 kPa, la o temperatură t1 = 27 ° C Odată eliberat din balon 14 g masă de azot, temperatura gazului devine egal cu t2 = 17 ° C Se determină presiunea azotului rămase în cilindru.
6. Capacitatea cilindrică V = 20 l cuprinde un amestec de hidrogen și azot, la o temperatură de 290 K și o presiune de 1 MPa. Se determină greutatea hidrogenului dacă masa amestecului este de 150 g
7. Azot 7g greutate este presurizată p = 0,1 MPa și la o temperatură T1 = 290 K. Deoarece azotul încălzire izobară volum ocupat V2 = 10 l. Definiți: 1) volumul de gaz, înainte de expansiune, 2) temperatura gazului după expansiune, 2), densitatea gazului înainte și după expansiune.

8. Într-o capacitate vas de 1 l este 1, masa de oxigen Se determină concentrația de molecule de oxigen în vas.

9. Într-un vas de 5 litri este azot, în condiții normale. Definiți: 1) cantitatea de substanță v; 2) masa de azot; 3) concentrarea n a moleculelor sale în vas.
10. viteza medie pătrată a unui gaz în condiții standard de 480 m / s. Câte molecule conține 1 g din acest gaz?

11. Capacitatea vasului V = 0,3 l la o temperatură T = 290 K este un gaz. Cum scade presiunea gazului în vas, în cazul în care din aceasta cauza scurgerilor va 19 octombrie N = molecule.

12. Se determină presiunea exercitată de gaz în peretele vasului, dacă ρ sale densitate = 0,01 kg / m3 și viteza medie pătrată a moleculelor de gaz este de 480 m / s.

13. Identificați viteza cea mai probabilă a moleculelor de gaz a căror densitate este la o presiune de 40 kPa este de 0,35 kg / m3.

14. Se determină energia cinetică medie (ε0) mișcarea de translație a moleculelor de gaz, presiunea de reglaj 0,1 Pa, și având o concentrație de molecule 13 octombrie -3 cm.

15. Definiți: 1) cel mai probabil VB; 2) media aritmetică v; 3) Valoarea medie a vitezei pătrat VKV moleculele de azot (N2) la 27 ° C
16. La ce temperatură este viteza efectivă a moleculelor de oxigen mai mare decât cea mai probabilă viteză de 100 m / s lor?

17. Folosind legea gazelor ideale de distribuție a vitezelor moleculare, găsi formula cel mai probabil, viteza Vc.
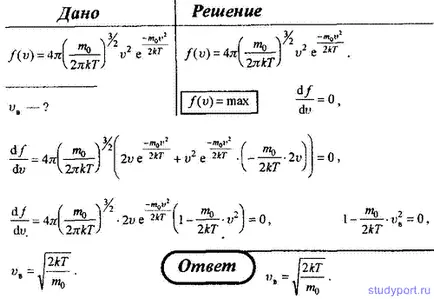
18. Folosind legea distribuției a moleculelor cu o viteză ideală de gaz, găsiți legea care exprimă distribuția moleculelor în viteza relativă u (u = v / VB).

19. Prin legea de distribuție a moleculelor de o viteză ideală de gaz, găsiți media aritmetică a vitezei v a moleculelor.
Notă: media aritmetică vitezei este determinată prin formula

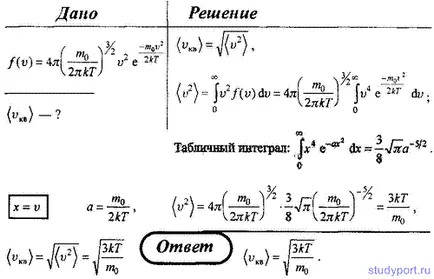
20. Folosind legea distribuției moleculelor vitezei gazului ideal, obține viteza medie pătratică (VKV).
Teoria moleculară-cinetică a gazelor ideale - Pagina 2
Pagina 2 din 3
21. Utilizarea funcției de distribuție a moleculelor unui gaz ideal în energie, găsiți energia cinetică medie (ε) molecule.

22. Utilizarea funcției de distribuție a energiei moleculare a unui gaz ideal, pentru a primi valoarea cea mai probabilă a moleculelor εv de energie.

23. Utilizarea funcției de distribuție a unei molecule de gaz ideale în energie, pentru a primi o temperatură dată raportul dintre media moleculelor cinetică £ energie pentru energia valoarea lor cea mai probabilă εv.

24. Legea de distribuție a gazelor a vitezei într-un fascicul molecular este de forma (v) f = Av 3 e -m0v ^ 2. defini: 1) viteza cea mai probabilă; 2) valoarea cea mai probabilă a energiei moleculelor din fascicul.

25. La ce altitudine presiunea aerului este de 60% din presiunea la nivelul mării? În soluția presupune că temperatura aerului este aceeași peste tot și 10 C.

26. presiunea aerului din mina, la o adâncime de 1 km, în cazul în care se presupune că temperatura pe întreaga înălțime constantă și egală cu 22 C, iar accelerația gravitațională nu depinde de înălțimea? Presiunea aerului la suprafața pământului este egală cu p0.

27. Se determină raportul de presiune a aerului la înălțimea de 1 km pana la presiunea din partea inferioară a adâncimii de foraj 1 km. Aerul la suprafață este în condiții normale, iar temperatura sa nu depinde de înălțimea.

28. La ce înălțime densitatea aerului este un factor de e (e - baza logaritmilor naturali), mai puțin în comparație cu densitatea acestuia la nivelul mării? Temperatura aerului și accelerația gravitațională considerată ca fiind independentă de înălțimea.
29. Utilizarea instalației Perrin idee pentru determinarea constanta Avogadro și aplicarea particulelor de vopsea în suspensie în apă, distribuția Boltzmann, obține volumul particulelor, dacă distanța dintre cele două straturi de 80 microni numărul de particule în suspensie într-un singur strat de două ori mai mult decât celălalt. Densitatea dizolvată colorantului 1700 kg / m 3 și temperatura ambiantă de 300 K.

30. Se determină media cale liberă I a moleculelor de oxigen, la temperatura de 0 C, dacă z este cunoscut numărul mediu de ciocniri cu experiență pentru 1 moleculă cu egal 3,7 * 10 9.

31. În ce presiune drumul liber de molecule de hidrogen este de 2,5 cm când temperatura gazului este de 67 C? molecule de hidrogen Diametru considerat egal cu 0,28 nm.

32. Se determină lungimea căii moleculelor medii libere de hidrogen τ, la o temperatură de 27 C și o presiune de 0,5 kPa, luând diametrul moleculei de hidrogen de 0,28 nm.

33. medie drumul liber lungimea l1 de molecule de hidrogen, în condiții normale este de 0,1 microni. Se determină lungimea medie drumul liber la o presiune de 0,1 MPa se obține, dacă temperatura gazului rămâne constantă.

34. La o temperatură de 300K și o presiune medie cale liberă I a moleculelor de oxigen este de 0,1 microni. Care este numărul mediu de coliziuni experimentate de molecule de 1, în cazul în care vasul este evacuat la o presiune inițială de 0,1? Temperatura gazului presupusă constantă.

35. Definiți: 1) p densitatea aerului în vas; 2) concentrarea n moleculelor sale; 3), lungimea medie cale liberă (l) a moleculelor, în cazul în care vasul este evacuat la o presiune de 0,13 Pa. Diametrul moleculelor de aer ia egal 0,27 nm. Temperatura aerului 300 K.

36. Determinarea termică λ coeficient de conductivitate de azot prezentă într-un anumit volum la o temperatură de 280 K. Diametrul efectiv al moleculelor de azot este de 0,38 nm.

37. Oxigenul este în condiții normale. Se determină termică λ coeficient de conductivitate de oxigen, în cazul în care diametrul efectiv al moleculelor sale este de 0,36 nm.
38. Spațiul dintre cele două plăci paralele de 150 cm 2 fiecare, situate la o distanță de 5 mm unul față de celălalt, umplut cu oxigen. O placă este menținută la o temperatură de 17 C, cealaltă - la 27 C. Se determină cantitatea de căldură care a trecut timp de 5 minute prin conducție de la o placă la alta. Oxigenul este în condiții normale. Diametrul efectiv al moleculelor de oxigen considerate egale cu 0,36 nm.

39. Definirea D coeficientul de difuzie a oxigenului în condiții normale. Diametrul efectiv al moleculelor de oxigen acceptă egală cu 0,36 nm.

40. Se determină masa azotului care trece prin investigarea în zona de difuzie de 50 cm2, timp de 20 s, în cazul în care gradientul de densitate în direcția perpendiculară pe site-ul este de 1 kg / m 4. Temperatura este 290 K și drumul liber de molecule este egal cu 1 um.

41. Se determină numărul de coeficienți diferiți de η viscozitate dinamică de dioxid de carbon și azot, în cazul în care cele două gaze sunt la temperatură și presiune identică. Diametrele eficiente de molecule ale acestor gaze sunt egale.

42. Se determină o conductivitate termică de azot, în cazul în care viscozitatea dinamică în aceleași condiții este de 10 Upa * c.

43. Azotul este sub o presiune de 100 kPa, la o temperatură de 290 K. determină coeficientul de difuzie D și r | frecare internă. Diametrul efectiv al moleculelor de azot luate egal 0,38 nm.
44. Mai jos, o anumită presiune se poate vorbi de un vid între pereții Dewar, dacă distanța dintre pereții vasului este de 8 mm, temperatura de 17 C, diametrul efectiv al moleculelor de aer este 0,27 nm.

45. Presiunea gazului rarefiate în tubul de raze X, la o temperatură de 17 ° C este de 130 uPA. Fie că este posibil să vorbim despre un vid înalt, dacă mărimea caracteristică a l0 (distanța dintre catod și anod a tubului) este de 50 mm? Diametrul efectiv al moleculelor de aer ia egal 0,27 nm.
