Tăria acizilor și bazelor
Constantele de aciditate și bazicitate
Constanta de echilibru este o caracteristică cantitativă a tăriei acid sau bazic. Cantitativ aciditatea calculată în raport cu apa. În același timp, o măsură a acidității acționează ca o reacție de echilibru constant (constant pH) $ Ka $. Pentru a exprima $ A ↔ B + H ^ + constantă $ aciditate este egal cu:
echilibru Standard are forma: $ H_3O ^ + ↔ H_2O + H ^ + $, $ Ka = 1 $. Apoi, pentru orice acid - procesul de bază:
$ A_1 + B_2 ↔ A_2 + B_1 $
În reacția acidului cu apă, fie $ A $ Constantele de echilibru corespund valorilor literaturii de referință date:
$ A + H_2O ↔ H_3O ^ + + B ^ - $
pentru acizii polibazici, favorizând în mod constant câțiva protoni, prima constanta de aciditate este întotdeauna mai mare decât următoarea;
oxoacizi pentru (grup $ $ -OH atașat la același atom) $ pK_ $ de obicei mai mare de $ pK_ $ la $ 5 $.
Valorile $ $ PK_ pentru acid fosforic sunt de $ 2,12 $; $ 7,21 $; $ 12,67 $ pentru $ i = 1,2,3 $, respectiv. Aceasta este, într-un mediu apos este dominat de diferit de acid - echilibrul de bază, în funcție de pH-ul $ $.
Rezolvarea controlului în toate subiectele. 10 ani de experiență! Preț de la 100 de ruble. Perioada de la 1 zi!
Scriem ieftin și tocmai la timp! Mai mult de 50 000 de profesioniști dovedit
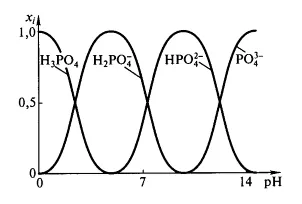
Figura 1: Dependența conținutului relativ de acid fosforic ioni diferiți de la $ pH $
Pentru valori mici ale pH-ului de $ parts $ ion $ ^ _ $ 4, instituția este foarte mic, dar la $ pH> $ pKa1 acest ion începe să domine. ioni protonate, în principal în soluția când $ pH $ este intermediară între respectiva valoare $ pKa $.constantă bazicitatea calculată din relația:
constanta Aciditatea poate fi atribuită relației constantă bazicitate:
Acidul conjugat mai puternic, baza conjugată a mai slab. Aceasta corespunde cu valoarea pK - $ lgKa $.
Acid este considerat puternic dacă $ a pKa
$ HA + H_2O = + A ^ - $ va merge aproape la sfârșitul și proprietățile acide sunt determinate exclusiv de proprietățile $ H_3O ^ + $.
Baza este într-o soluție apoasă a unui puternic, dacă $ pKb
O valoare pKa de $ $ la acizi slabi sunt în gama de $ \ sim 2-15,7 $.
apă autoprotolysis
Autoprotolysis echilibrul apei este după cum urmează:
Pentru această reacție, constanta de echilibru termodinamic este setată experimental. La o temperatură de 298 $ \ K $ este egal cu:
$ K = [H_3O ^ +] [OH ^ -] = 1 \ cdot 10 ^ $
Aceasta se numește echilibru ionic produs constant de Kw apă $. $
. Conform teoriei reacției protolytic autoprotolysis echilibru constant de apă este o aciditate constantă $ Ka (H_2O) $ Bazat pe valoarea $ Kw $, definită gama $ pH $:
Conform Bronsted Theory - Lowry, săruri, hidroliză poate fi considerat ca un caz special al acidului - echilibrul de bază. Hidroliza - interacțiunea de schimb de ioni cu care curge din schimbarea pH-ului de $ $ apă.
Hidroliza anionului reprezentat prin ecuația:
Hidroliza constantă $ $ este o bazicitate Kr constantă a bazei conjugate de $ CH_3COO ^ - $.