Spin-orbită interacțiune - Enciclopedia chimică
Spin-orbită de interacțiune. interacțiunea dintre magnet. momente asociate cu spinul și momentele orbitale numără mișcarea electronilor și nucleelor în sistemul cuantic - atom. moleculă. cristal, etc. Contribuția de interacțiune spin-orbită la energia face ca sistemul să îndeplinească condițiile de trei rom ale Hamiltonianului în ur Schroedinger. Primul termen se datorează magneziu. câmp relativ la rezultate în mișcare nucleele de electroni în electrice. câmp care acționează asupra nucleului și de spin magn. timp; a doua este cu un magnet. câmp apar în timpul mișcării unui electron în electrotehnică. domeniu al tuturor celorlalti electroni. a treia sau cu interacțiunea. învârti un magnet. timpul de electroni cu magneziu. produse de către toate celelalte electroni în mișcarea lor.
Pentru electroni, i și j cu vectori rază R 'și Rj și impulsuri (moment de mișcare count) pi și pj interacțiunea lor de spin-orbită între ele și cu miezurile și tarifele percepute de la-ryh egal cu Z o (în termeni de încărcare elementară e ) și vectorii raza de Ra. Aceasta duce la un supliment. contribuții la hamiltonianul sistemului, constând din următoarele. trei sume:
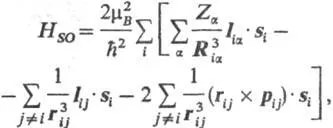
Din aceste sume, de obicei DOS. contribuția la energia sistemului furnizează prima, în timp ce al doilea și al treilea (acestea sunt numite de obicei. „interacțiunea spin-orbitală a celuilalt“) oferă o contribuție mult mai mică. Dacă au neglijat interacțiunea spin-orbită este după cum urmează:
coordonează undeva Fct de electroni și nuclee, și nuclee de taxe. Aceste fct proporționale, astfel încât atunci când o medie peste toate pozițiile posibile electroni Naib. aceste configurații de sistem esențial în electroni-k ryh sunt in apropiere de nuclee. Dacă molecula val f-TION formate din mol. orbitali sub forma unei combinații liniare de orbitali atomici (vezi. LCAO aproximare), valorile medii ale principalelor integralele contribuție calculată cu orbitali atomici de ca. centrat pe miezul unei (cm. Orbital). De obicei Fct pentru atomii se înlocuiește cu constantele nek- care depind de n principal și l numerele cuantice orbitale (Ri Ra.); au sunat. constante interacțiuni spin-orbită. Atomii de hidrogen este proporțională cu Z 4 și n este invers proporțională cu 3. atomii multi-electroni are loc ecranare electroni kernel și Dependență constantă interacțiune spin-orbita pe Z și n devine mai puțin pronunțată și funcțional mai complex. Cu toate acestea, în acest lucru și într-un alt caz, interacțiunea spin-orbită Naib. ext mare pentru electroni. cochilii de atomi grei. în timp ce moleculele de ext. coji de miezuri atomice, permițând Funcțiilor densitatea de interacțiunile spin orbitalnoh și molecule folosind constantele atomice
Cu interacțiunea pini orbital duce la divizarea nivelelor degenerate multiplei care este prezentat în atomic și mol. Spectrele ca structură fină. Astfel, datorită interacțiunii spin-orbită nivel inferior excitat de atomi de metal alcalin este împărțit în două: 2 P1 / 2 și 2 P3 / 2. unde subscriptului indică momentul cinetic numărul total cuantic al numărului de mișcare a electronilor în exterior. shell drepte. Pentru Na (Z = 11, n = 3), această divizare este 17,2sm -1. pentru K (Z = 19, n = 4) 57,7 cm-1. pentru Cs (Z = 55, n = 6) 554.1 cm-1. La mulți atomi de halogen de despicare np nivele pentru electroni chiar interacțiune mai constantă și spin-orbita este după cum urmează: F la 272 cm -1. pentru CI 587 cm-1. I la 5060 cm-1. Pentru suficient de puternică interacțiune spin-orbită a conceptului de multitudinea de termeni, în general, își pierde sensul și este considerat un număr de normă întreagă al mișcării de electroni. în loc de spin și momentul cinetic orbital separat. Interzicerea tranzițiilor cuantice între niveluri diferite de multiplicitate în prezența interacțiunii spin-orbită este îndepărtată, ceea ce conduce, de exemplu. la fosforescență - radieze. tranziția de la statele cu vieți sunt invers proporționale cu pătratul elementelor de matrice ale interacțiunii spin-orbită, și în terkombinats. conversie (vezi. luminiscență. reacție fotochimică). De la momentul fosforescente depinde nu numai în mod direct de la un timp de viață „fosforescent“ stare a moleculelor. dar, de asemenea, asupra mediului într-un roi, acestea sunt, pentru a ține seama de această dependență este introdusă ideea de interacțiune spin-orbită intermoleculară. poliatomic diatomice și liniare molecule raportul dintre interacțiunea spin-orbită și altele. Interactions, de exemplu. spin-rotire, vă permite să selectați decembrie cazul conexiunii de spin. orbital și colab. momente (vezi. de cazuri de comunicare Hund), ceea ce face posibilă efectuarea de comunicații fiecare caz specificitate. stări cuantice de clasificare a moleculei.
În expresia pentru HSO nu este reprezentat termenul de interacțiune corespunzătoare. magnet nuclear. momentul unghiular de spin și moment cinetic orbital de electroni. Unde ai un (Ri a) = factor, g un -g-un nucleu. m N - ton Magne nucleară, am o - de spin nuclear. Asociate cu acest termen niveluri de divizare semnificativ mai mică decât datorită cuplării de spin-orbită; de ex. pentru starea electronica 2 P1 / 2 atom Na ai o valoare de 94,5 MHz, cât și pentru stat 2 P3 / 2 -19.1 MHz, adică aproximativ 0,003-0,001 cm-1. De obicei, membru I a fost izolat (împreună cu alții. Membrii același ordin de mărime) în interacțiunea hiperfine orbital. sau magnet nuclear hiperfine. interacțiune, prezentat în spectrele RES (cm. Electron rezonanță paramagnetic).
Lit. cm. în conformitate cu art. Spin. NV Stepanov.
