Proteinele și peptidele
chimie Bioorganic
Proteinele și peptidele.
Proteine - greutate compus moleculară mare natural conținând azot organic. Acestea joacă un rol principal în toate procesele de viață, sunt purtătorii vieții. Proteinele se găsesc în toate țesuturile organismului, sânge, oase.
Proteine. precum și carbohidrați și grăsimi - cea mai importantă componentă a nutriției umane.
Structura chimică a proteinelor
Moleculele proteice sunt formate din resturile de aminoacizi conectate la catena printr-o legătură peptidică.
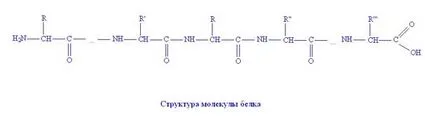
Formarea legăturii peptidei are loc atunci când proteinele din interacțiunea grupării amino (-NH2) a unui aminoacid cu o grupare carboxil (-COOH), cu un alt aminoacid.
dipeptide format (un lanț de doi aminoacizi) și molecula de apă a doi aminoacizi.
Zeci, sute, sau mii de molecule de aminoacizi, care leagă între ele pentru a forma un gigant proteine molecula.
In moleculele de proteine se repeta de mai multe ori grupa atomii -CO-NH-; acestea sunt numite amida. sau grupe de peptide în chimia proteinelor. Prin urmare, proteinele denumite poliamide sau polipeptide macromoleculare naturale.
Numărul total de aminoacizi naturali este de 300, dar unele dintre ele sunt destul de rare.
Dintre aminoacizii, un grup de 20 cel mai important. Acestea se găsesc în toate proteinele si sunt numite acizi alfa-amino.
Toate varietate de proteine, în cele mai multe cazuri este format de acești douăzeci de acizi alfa-amino. În acest caz, specificitatea strict este secvența pentru fiecare proteină, în care resturile de constituenții săi aminoacizi legați unul de celălalt. Compoziția de aminoacizi a proteinelor este determinată de codul genetic al unui organism.
Proteinele și peptidele
Și proteine. și peptide - un compus construit din resturi de aminoacizi. Diferențele Kollichestvennye între ele.
Convențional, consideră că:
- peptidele conțin în molecula de până la 100 de resturi de aminoacizi (corespunzând unei mase moleculare de 10 000) și
- proteine - mai mult de 100 de resturi de aminoacizi (masă moleculară de la 10 000 până la câteva milioane).
La rândul său, grupul de peptide pentru a distinge între:
- oligopeptide (peptide cu greutate moleculară mică), care nu conțin mai mult de 10 de resturi de aminoacizi în lanț, și
- polipeptide. în lanțul care include până la 100 de resturi de aminoacizi.
Pentru macromolecule cu un număr de resturi de aminoacizi, care se apropie sau ușor mai mare decât 100, termenii polipeptide și proteine practic delimitate și ele sunt adesea sinonime.
Structura proteinelor. niveluri ale organizației.
O moleculă de proteină este entitate foarte complexă. proprietățile proteinelor depinde nu numai de compoziția chimică a moleculelor sale, ci și de alți factori. De exemplu, structura spațială a moleculei, prin legături între atomii conținute în moleculă.
Există patru niveluri de organizare structurală a moleculelor de proteine.
1. Structura primară
Structura primară este o secvență de resturi de aminoacizi în aranjamentul lanț polipeptidic.
Secvența de resturi de aminoacizi în lanțul este cea mai importantă caracteristică a proteinei. Ea determină proprietățile de bază.
Proteina fiecare persoană are o structură primară unic asociat cu codul genetic.
2. Structura secundară.
Structura secundară legată de orientarea spațială a lanțurilor polipeptidice.
Principalele sale tipuri:
- alfa-helix,
- beta-structura (o vizualizare a foii pliate).
Structura secundară este fixă, de obicei, prin legături de hidrogen între atomii de hidrogen și oxigen grupări peptidici, distanțate 4 unitate.
legături de hidrogen sunt ca spirala reticulată care deține un lanț polipeptidic într-o stare răsucită.
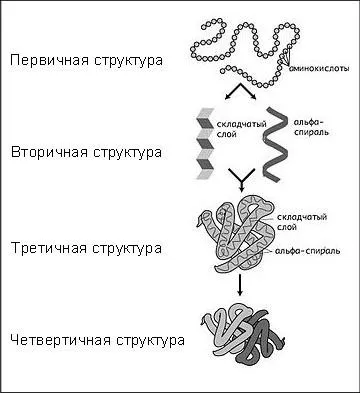
3. Structura terțiară
Structura terțiară reflectă forma spațială a structurii secundare.
De exemplu, structura secundară sub forma unei spirale, la rândul lor, pot avea o formă sferică sau ovoidală.
Structura terțiară este stabilizat nu numai legături de hidrogen, dar și alte tipuri de interacțiuni ionice, cum ar fi, hidrofobe, și legături disulfidice.
4. Structura cuaternară
Primele trei niveluri sunt caracteristice organizării structurale a moleculelor proteice.
Al patrulea nivel este întâlnită în timpul formării complexelor proteice formate din mai multe lanțuri polipeptidice.
Această formațiune complexă supramoleculare constând din mai multe proteine având propria primară, structura sa secundară și terțiară.
Compoziția structurii cuaternare de proteine pot include atât catene polipeptidice identice și diferite.
Asociere lanțuri de polipeptide într-o structură cuaternară poate duce la apariția unor proprietăți biologice noi absente în proteinele originale care formează această structură.
Cuaternară stabilizarea structurii participă aceleași tipuri de interacțiuni care stabilizează terțiară.
Clasificarea proteinelor
Datorită varietății de peptide și proteine, există mai multe abordări pentru clasificarea acestora. Acestea pot fi clasificate în funcție de funcțiile biologice, compoziția și structura spațială.
In compoziție, proteinele sunt împărțite în:
Hidroliza proteinelor simple de acizi numai alfa-amino sunt obținute ca produs de clivaj.
Proteinele complexe, împreună cu o parte corespunzătoare de proteine constând din acizi alfa-amino, conține o porțiune nonpeptide organică sau anorganică numite grupări prostetice.
Exemple de proteine complexe pot servi ca proteine de transport mioglobina și hemoglobina. în care o parte a proteinei - globina - conectat cu gruparea prostetică - hem. Prin tip de grup protetice din care fac parte hemoproteină.
Phosphoproteins conțin reziduuri de acid fosforic, metaloproteinelor - ioni metalici.
biopolimeri mixte sunt, de asemenea, proteine complexe. În funcție de natura grupării protetice care sunt împărțite în:
- Glicoproteine (care conține un rest de carbohidrat),
- Lipoproteine (o porțiune care conține lipide)
- Nucleoproteine (conțin acizi nucleici).
In corpul uman, proteinele sunt rareori găsite în formă „pură“. Practic acestea sunt o parte din structuri complexe, cu un înalt nivel de organizare, care cuprinde, ca subunități ale altor biopolimeri și diferite grupări organice și anorganice.
Conform structurii spațiale a proteinelor este împărțită în două mari clase:
Pentru o proteină structură tipică globulară alfa elicoidale și lanțul său curbat în spațiu, astfel încât macromolecula ia forma unei sfere.
proteine globulare sunt dizolvate în apă și soluții de sare pentru a forma sisteme coloidale.
Exemple de proteine globulare - albumina (proteina din ou) globină (porțiunea de proteină din hemoglobină), mioglobina. aproape toate enzimele.
mai tipic beta-structură fibrilară proteine. De regulă, ele au o structură fibroasă, nu se dizolvă în apă și soluții de sare.
Acestea includ multe răspândite proteine - beta-keratin (păr, țesut corn), beta-fibroină (mătase), mioinozin (țesutul muscular), colagen (țesut conjunctiv).
Functia proteinelor din organism.
Clasificarea proteinelor conform funcției lor este mai degrabă condiționată, deoarece una și aceeași proteină poate îndeplini mai multe funcții.
Mai jos am lista funcția principală a proteinelor din organism:
1. Funcția catalitică.
Proteinele din acest grup sunt numite enzime. Enzime catalizează o varietate de reacții chimice. De exemplu, scindarea moleculelor complexe (catabolism) și sinteza (anabolism).
Exemple de proteine catalitice: catalaza, alcool dehidrogenazei, pepsina, tripsina, amilaza și așa mai departe.
Funcția 2. Structura
celule în formă și organite sale. De exemplu, actină și tubulină monomeri formează filamente lungi care cuprind citoscheletului, permițând celulei să mențină forma. Colagenul si elastina - componentele de bază ale matricei extracelulare a țesutului conjunctiv (de exemplu cartilaj), si o alta a cheratinei proteinelor structurale constau păr, unghii, pene și unele coajă.
3. Funcția de protecție
Există mai multe tipuri de funcții protectoare ale proteinelor:
- Protecția fizică Protecția fizică a organismului furnizează colagen - o proteină, care formează baza substanței intercelulare a țesutului conjunctiv (inclusiv oase, cartilagii, tendoane și straturile profunde ale pielii (derm)); keratina. care formează baza excitat, păr scuturile, pene, coarne etc. derivate ale epidermei. De obicei, astfel de proteine sunt considerate proteine cu funcție structurală. Exemple de acest grup de proteine sunt fibrinogen și trombină. implicate în coagularea sângelui.
- Protecția chimică a Binding molecule proteice toxina poate furniza detoxifiere lor. Un rol deosebit de important în detoxifierea persoana care joacă enzimele hepatice. scindeze otrăvuri sau să le transforme într-o formă solubilă, care facilitează excreția lor rapidă din organism.
- proteine de aparare imunitar care formeaza sange si alte fluide biologice sunt implicate în răspunsul protector al organismului atât prejudiciul și atacul agenților patogeni. Neutralizeaza bacterii, virusuri și proteine străine.
4. Funcția de reglementare
Proteinele din acest grup reglementează diferite procese care au loc în celule sau într-un organism. Pentru proteinele din acest grup includ: proteine, hormoni. Proteinele receptor și așa mai departe.
Hormonii sunt transportate de sânge. Majoritatea hormoni animal - sunt proteine sau peptide. Anumiti hormoni regleaza concentratia de substante in sange si a celulelor, creșterea, reproducerea și alte procese. Un exemplu de astfel de proteine este insulina, care regleaza concentrația de glucoză din sânge.
Funcția de alarmă 5.
Proteinele semnal functioneaza - capacitatea proteinelor servi ca substanțe care trec semnale între celule, țesuturi, organe și organisme de semnalizare. Adesea, funcția de alarmă este combinată cu semnale de reglementare, deoarece multe proteine de reglementare, de asemenea, sunt intracelulare transmit.
Semnalizarea funcționale efectuate proteine hormoni, citokine, factori de creștere, și altele. Legarea hormonului de receptorul este semnalul care declanșează reacția de celule de răspuns.
Celulele interacționează unele cu altele, folosind proteine de semnalizare transmise prin substanță intercelulară. Aceste proteine includ, de exemplu, citokine și factori de creștere.
Funcția 6. Transport
Proteinele participă la transferul substanțelor în celule și de celule în mișcările lor în interiorul celulei și în sângele lor de transport și alte fluide prin corp.
Un exemplu de proteine de transport pot fi numite hemoglobina. care transporta oxigenul de la plamani la alte tesuturi si dioxidul de carbon din tesuturi la plamani, precum si omolog cu proteinele găsite în toate împărățiile organismelor vii.
Unele proteine membrana implicate in transportul moleculelor mici prin membrana celulară prin modificarea permeabilității sale.
7. Înlocuirea funcție (de rezervă)
Aceste proteine sunt așa-numitele proteine de rezervă, care sunt rezervate ca sursă de energie și substanța în semințele de plante (de exemplu, 7S globulina și 11S) și ovocite de animale. O serie de alte proteine din organism este utilizat ca sursă de aminoacizi. Proteinele Exemple de rezervă sunt cazeină. ovalbumină.
Funcția 8. receptor
Receptorii de proteine sunt localizate atât în citoplasmă sau încorporată în membrana celulară.
Receptorii reacționează schimba configurația lor spațială pentru conectarea la acestea molecule ale anumitor substanțe chimice, care transmite semnalul extern la regulator și, la rândul său, transmite semnalul în celulă sau celulă organelle.
9. Motor funcția (motor)
motor de proteine cu motor de proteine - o clasă de motoare moleculare, care se pot deplasa. Ei tranformiruyut energie chimică conținută în ATP. energie în mișcare mecanică.
Proteinele cu motor furnizează mișcarea corpului, cum ar fi contracția musculară.
Pentru motorul proteine includ proteine ale citoscheletului - dyneins. kinesinele. precum și proteine implicate în contracția musculară - actina. miozină.