Principalele tipuri de legături chimice
Un corp solid este format din particule care, atunci când suficientă convergență sunt forțe de interacțiune interconectate. Particulele pot fi atomi, ioni sau molecule. Pentru stabilitatea structurii corpului solid trebuie să echilibreze forțele de atracție și repulsie între particule. comunicarea divide Accepted între particule solide după cum urmează. Ne Van der Waals, ionic (polar), covalentă. metal și hidrogen.
Ele sunt cel mai comun tip de comunicare care există în toți compușii atomilor și moleculelor. Acestea au fost folosite pentru prima dată pentru a justifica ecuația de stare a gazelor reale - van der Waals
în care corecțiile determinate asociate cu acțiunea forțelor de atracție a / V b 2 și repulsie între moleculele unui gaz reale. Practic aceste forțe pure au loc între molecule cu legături chimice saturate (O2. H2. Et al.), Precum și între atomii gazelor inerte, în stare lichidă sau solidă. Comunicarea Van der Waals include trei interacțiuni:
Dispersia interacțiune. Luați în considerare această interacțiune poate fi, de exemplu, doi atomi de heliu (Figura 1). In atomul de heliu distribuția densității de electroni este simetrie sferică, adică, momentul mediu electric al atomului este zero. La momente diferite, electronii sunt aranjate în anumite puncte ale spațiului, creând o rapid variabile dipolii electrice instantanee. Atunci când doi atomi de heliu în mișcarea electronilor lor de corelare stabilit (potrivire), care dă naștere la forțe de interacțiune. Aceste forțe pot fi dublu. Dacă mișcarea electronilor este corelată așa cum este prezentat în figura 1a, dipolii are loc între atracție instantanee care duce la atomi de comunicare. În cazul prezentat în figura 1 b, atomii sunt respinse. Într-o primă variantă de realizare (Figura 1 a) energie a sistemului este redus, cu toate acestea, acest caz este mai probabilă și acest lucru determină apariția unei forțe permanente de atracție între atomii de heliu. Aceste forțe de legare sunt numite dispersie.
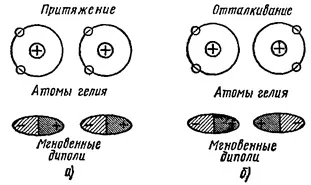
Figura 1. Interacțiunea de dispersie.
Pentru o astfel de forță în 1930, a fost produs pentru prima dată calculat la Londra. Baza modelului de calcul a fost indus dipol în atom, care are loc sub influența dipol electric instantaneu un alt atom, ceea ce conduce la realizarea configurației din figura 1, de asemenea. Expresia de calcul pentru energia de interacțiune de dispersie este egală cu:
interacțiune orientational. Când moleculele au un moment de dipol permanent M, m. E. Ele sunt polare, între ele interacțiune electrostatică se produce, care tinde să aranjeze aceste molecule într-o manieră ordonată (Figura 1.2), deoarece în această poziție energia sistemului scade.
Orientarea moleculelor la temperaturi joase și o energie totală maximă a interacțiunii este dată de
În cazul în care r - distanța intermoleculară, - constanta dielectrică.
Pentru temperaturi ridicate ca Rees definit, energia interacțiunii moleculelor dipolare se determină prin formula
Interacțiunea în numita orientare.
interacțiuni inductive. In moleculele polare care posedă o polarizabilitatea ridicată se poate produce induse punctul (induse), sub influența dipolilor permanente de câmp moleculele învecinate. Debye a arătat că energia atracție între dipol rigid al primei molecule și dipol doua moleculă indusă este independentă de temperatură și este definit de relația
Această interacțiune se numește inducție sau deformarea.
Când două molecule poate apărea în general toate cele trei tipuri de conexiuni, iar energia de interacțiune este compusă din energia de mai sus
Contribuția fiecărei porțiuni la energia totală la Van der Waals legătura este diferită în funcție de molecula.
Epifanov GI Fizica Solid State.