Pregătirea și utilizare
NO2 se obține prin oxidarea catalitică a amoniacului într-un exces de oxigen sau de oxidare a NO în aer:
precum și prin reacțiile:
La temperatura camerei, NO2 - gaz de culoare maro închis, are proprietăți magnetice datorită prezenței electronilor nepereche. La temperaturi sub 0 ° C moleculă NO2 dimerizează în tetraoxid de diazot, în care la -9.3 ° C continuă dimerizare complet: 2NO2 N2O4. În stare lichidă nedimerizovano doar 1% NO2, dar rămâne sub formă de 10% dimer N2O4 la 100 ° C,
NO2 (sau N2O4) reacționează în apă caldă pentru a forma acid azotic: 3NO2 + H2O = 2HNO3 + NO. Prin urmare, tehnologia NO2 este foarte esențial ca etapă intermediară de obținere a produsului important industrial - acidul azotic.
oxid nitric (V) N2O5 - substanță cristalină albă obținută prin deshidratarea acidului azotic în prezența P4O10 oxid de fosfor (acid azotic anhidridă Deprecated.):
N2O5 se dizolvă ușor în umiditatea atmosferică, re-formarea HNO3. Proprietățile sunt determinate de echilibrul N2O5
N2O5 - oxidant bun reacționează ușor, uneori violent, cu metale și compuși organici, în stare pură, atunci când este încălzit explodeaza. Probabilă Structura N2O5 poate fi reprezentat ca
Oxoacizi de azot. Pentru azot trei oxoacizi cunoscute: H2N2O2 gipoazotistaya, azotos și azotic HNO2 HNO3.
Acid Gipoazotistaya H2N2O2 - foarte compus instabil, se formează într-un mediu neapos a unei sări de metal greu - giponitrita alta sub acțiunea acidului: M2N2O2 + 2HX 2MX + H2N2O2. Prin evaporarea soluției formate substanță explozivă albă cu structura propusă H-O-N = N-O-H.
HNO2 acid azotos nu există în formă pură, dar soluțiile sale apoase de concentrație scăzută formate prin adăugarea de acid sulfuric la nitrit de bariu:
acid nitros este de asemenea format prin dizolvarea unui amestec echimolecular de NO și NO2 (sau N2O3) în apă. acid nitros ușor mai puternic acid acetic. Gradul de oxidare a azotului în ea 3 (structură H-O-N = O), adică poate fi, de asemenea, un oxidant și reducator. Sub acțiunea agenților este în mod normal, readuse la NO reducerea, și prin reacția cu oxidanți este oxidat la acid azotic.
Viteza de dizolvare a unor substanțe, cum ar fi metale sau ioni de iod, acid azotic depinde de concentrația de acid prezentă azotos ca impuritate. Sărurile acidului nitrici - nitriții - sunt ușor solubile în apă, cu excepția nitrit de argint. NaNO2 este utilizat la fabricarea coloranților [15,9,14].
Obținerea și primenenieazota
In laborator, azotul poate fi ușor obținut prin încălzirea concentrat nitrit de amoniu:
NH4NO2 = N2 + 2H2
In curat laborator ( „chimic“) a fost preparat prin adăugarea de azot atunci când este încălzit NH4Cl soluție de clorură de amoniu saturată cu solid nitrit de sodiu NaNO2 sub încălzire:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O
O. Metoda tehnică de producere a azotului se bazează pe separarea aerului lichefiat anterior, care este apoi supus distilării. Pentru acest prim răcit cu aer este lichefiat și aerul lichid este supus distilării (distilare). Punctul de fierbere al azotului este puțin mai mic (-195,8 ° C), altele decât componentele de aer - oxigen (-182,9 ° C), prin urmare, primul azot evaporată cu aer lichid încălzire blândă. Consumatorii de gaz de azot este furnizat într-o formă comprimată (150 atm., sau 15 MPa) în cilindri de negru având o inscripție „azot“ galben.
Cea mai mare parte din azotul liber produs este utilizat pentru producția industrială de amoniac, care este apoi în cantități semnificative este procesat în acid azotic, îngrășăminte, explozivi, și așa mai departe. D. În plus față de sinteza directă a amoniacului din elementele de importanță industrială pentru legarea azotului din aer a dezvoltat în 1905 metoda cianamidă, bazat pe faptul că carbura de calciu 10000S (obținută prin încălzirea unui amestec de var cărbune într-un cuptor electric) reacționează cu azotul liber:
CaC2 + N2 = CaCN2 + C
Rezultat cianamidă de calciu prin acțiunea vaporilor de apă supraîncălziți se descompune pentru a elibera amoniac:
CaCN2 + 3H2O = CaCO3 + 2NH3.
acces fără azot este utilizat în multe industrii .. Ca mediu inert într-o varietate de procese chimice și metalurgice, pentru a umple spațiul gol din termometre cu mercur, când se pompează lichide inflamabile etc. Azotul lichid găsește aplicare în diferite sisteme de refrigerare. Acesta este stocat și transportat în oțel vasele Dewar, azotul gazos este comprimat - în cilindri. Pe scară largă sunt folosiți mulți compuși cu azot. Producția de azot fix a fost dezvolta viguros după primul război mondial și a atins acum proporții enorme. [14]
Partea experimentală. descompunere Prepararea azotului nitrit de amoniu
Azotul a fost preparat în laborator prin reacția unei soluții saturate de clorură de amoniu și nitrit de potasiu. Nitritul rezultată de metateză de amoniu este ușor de descompus pentru a forma azot și apă.
Hardware: Flacon Wurtz pâlnie de separare, tub de vapori, așchii, cilindru de sticlă, o matriță, o placă de sticlă, un trepied arzător.
Siguranță. Respectați regulile încălzitoarelor.
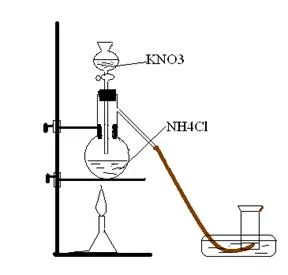
Experiment: Într-un balon Wurtz se toarnă o soluție de clorură de amoniu 20 ml, și o pâlnie de picurare o soluție de nitrit de potasiu. Când turnarea nitrit de potasiu, printr-o pâlnie de evoluție azot cădere începe la balon. La început, reacția are loc încet și apoi accelerează. Este necesar să se încălzește vasul cu clorură de amoniu, dacă reacția nu este suficient de rapid.
KNO2 + NH4Cl = KCl + NH4NO2
NH4NO2 = N2 + 2H2O
Punerea prinderea buteliei de azot. Trebuie să colecteze felul următor: un cilindru umplut cu apă, pentru a transforma cu susul în jos și a pus într-o matriță cu apă și se aduce la tubul de vapori. Este un gaz incolor, puțin solubil în apă. Arderea așchie sub azot se stinge. Lăsați deschide cilindrul, după un timp se va face o așchie aprins în cilindru din nou. sejururi Splinter. Azotul se evapora din cilindru. Azotul este puțin mai ușor decât aerul.
Și când se formează sbaltyvanii apă calcaroasă în cilindru cu precipitatul azot, în contrast cu agitând cu dioxid de carbon.
Concluzie: Rezultatul sintezei azotului obținut, care a confirmat prin experimente [17].
Azotul este un element foarte important și interesant nu numai în chimie, ci și pentru chelovechetva în general. În mare parte din azotul se găsește în natură în stare liberă. 2 are un izotop stabil. molecula sa este foarte stabil și puțin reactivă numai la temperaturi foarte ridicate, acesta reacționează cu o varietate de metale și nemetale. S-au găsit unele similitudini cu atomul de azot, atomul de carbon.