Modul I
alcooli radicali funcționali și nomenclaturi de înlocuire.
nume alcooli pe substituție nume IUPAC generate prin adăugarea alcanilor corespunzătoare de închidere „ol“; prin Radical - denumirea din nomenclatura funcțională formată din numele radicalului corespunzător cu adăugarea capătului „alcool -ovy.“
Numerotarea circuitului principal încep de la sfârșit, care este mai aproape de gruparea OH.
În funcție, la care atomul de carbon este o grupare hidroxi, se face o distincție între primar (1-propanol), secundar (2-propanol) și terțiar (2-metilpropanol-2) alcooli.
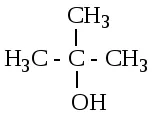
1-propanol 2-propanol 2-metilpropanol-2
alcooli izomerie.
Pentru alcooli, caracterizate prin izomeri structurali:
lanțului de carbon izomerie;
izomeri poziționali ai grupului funcțional.
Proprietățile fizice ale alcoolilor. Legătura de hidrogen.
Primii reprezentanți ai seriei omoloage de alcooli - lichizi, alcooli superiori - solide. Absența moleculelor alcooli gazoși explicată capacitatea de a forma legături de hidrogen intermoleculare. Primii reprezentanți alcooli (metanol, etanol, propanol) sunt miscibili cu apa în orice proporție datorită formării de legături de hidrogen cu moleculele de apă. Cu creșterea solubilității alcooli cu greutate moleculară în apă scade brusc. alcooli superiori sunt practic insolubile în apă.
alcooli inferiori au un miros caracteristic de alcool, miros puternic și mediu Omologii neplăcut. alcooli superiori sunt practic inodoră și alcooli terțiari au un miros neplăcut de mucegai.
Alcoolii au puncte de fierbere anormal de mari în comparație cu alcani, eteri, tioli. Aceste diferențe sunt explicate prin prezența legăturilor intermoleculare în moleculele de alcool.
Mecanismul de formare a legăturilor intermoleculare.
un atom de oxigen în molecula de alcool are electronegativitate ridicată și trage densitatea electronică a atomului de hidrogen. în care atomul de hidrogen apare δ +. și un atom de oxigen δ -. De aceea, hidrogenul este atras de electrostatică atomul de oxigen al altei molecule și legătură de hidrogen are loc între ele. Molecule interconectate prin legături de hidrogen pentru a forma asociați.
gradul asociate deoarece crește greutatea alcoolului și reduce volatilitatea acestuia. Pentru a rupe aceste legături necesită energie suplimentară, iar acest lucru se datorează punctul de fierbere ridicat.
Cea mai mare tendința de a forma legături de hidrogen prezintă alcooli primari. Pentru alcooli secundari și terțiari, în special capacitatea de asociere a redus ca radicali hidrocarbonați ramificați legături de hidrogen stânjeni.