Mecanismul de formare a legăturii
atom metaloid ia electronii exteriori din atom de metal și este transformat în anioni (ion încărcat negativ). Atomul de metal pierde electroni și este transformat într-un cation (ion pozitiv). Ionii sunt legate prin forțe electrostatice. Există o întoarcere completă (adoptarea) a electronilor de valență, nu se observă nici o suprapunere de partajare nor de electroni.
1. Compușii ionici au un punct de topire ridicat și o volatilitate scăzută. Acest fenomen se datorează atracției electrostatice puternice între cationi și anioni din compus. Astfel, în cristalul de clorură de cesiu, ion de cesiu este înconjurat de opt dintre ionii de clor prezenți la cea mai mică distanță de acesta și fiecare ion clor - opt ioni de cesiu.
2. Ionic compuși, de obicei, au o conductivitate electrică scăzută în stare cristalină, deoarece ionii în rețeaua cristalină, nu sunt capabile de mișcare de translație. Ionii se topește astfel capacitatea de câștig, având ca rezultat ionic topește compusi bun motiv curentul electric.
3. Cristale ionice sunt greu, dar fragile. Duritatea compușilor ionici se datorează lipsei de direcții în care rețeaua cristalină ar putea exfolia, cum ar fi în cazul cristalului de grafit. Friabilitate cristale ionice, datorită faptului că, chiar și o ușoară deformare a grilajului sunt însoțite de convergența de ioni, cum ar fi-încărcat, prin echilibrul forțelor repulsive și atractive este rupt pauze și cristal.
4. Compuși ionici în mod normal, în mod apreciabil solubili în solvenți polari. Solvenții polari sunt caracterizate prin valori ridicate ale constantei dielectrice, care este asociat cu energia de interacțiune a două ecuații particule încărcate.
12. bond metalic: mecanismul de formare, caracteristici de comunicare.
Me-tal-fie-che-LIC comunicare - un tip de comunicare în me-tal-cristale și Insulele lor SPLA între atomii de-ma-mi sau ion-mi mi-tal-captură și pe-no-see-Tel încă sale baud-HN-E elec-tro-na-mi (elec-tron NYM gaz) a fost Cree-Th-Are-D-XYZ Sheth-ke.
Mecanism de-ra-zo-va-niyama-tal-li-Th-TION svyaziso-sute urmeaza a-do-lea prezent: me-tal-pescuit atomi de da dizolvat în Rouge electroni LARG TPO-ne, și Neko-the-secară sunt pre Vera-conductive-de-Xia în on-lo-dna Tel dar pentru ionii mănăstirii soții-lat. Oto-rvav-shi-i-Xia atomi de mov elec-tro-HN-of-but-B, dar ei Tel-baud ne-no-re-me-conductive-dizolvat Xia între căruța-nick-Shih mi-Lo pe dna-Tel-HN-mi-mi ion me-tal-pescuit. Intre aceste ca-mi-ca sti cart-nor-ka-o legătură me-tal-li-Th-lic, r. F. Elec-tro-HN ca și tse-men-ti-py-dizolvată în lo ionii -zhi-Tel-WIDE în mine-tal-fie-che-TION re-Sheth-kyo.
Caracteristici. Pentru toate metalele sunt caracterizate prin conductivitate electrică și termică, ductilitate, luciu metalic, de obicei, de culoare gri și opacitate.
bond 13. covalentă: mecanismul de formare, caracteristici de comunicare.
legături covalente - legătura chimică între doi atomi, socializarea se produce atunci când electronii aparținând acestor atomi.
În cazul unui nor de electroni legătură covalentă nepolară format prin comun perechea de electroni, sau norul de comunicații electronice distribuite simetric în spațiu în raport cu nucleele celor doi atomi. Exemplele includ molecule diatomice care constau din atomi de un singur element: H2. Cl2. O2. N2. F2 și colab., În care perechea de electroni aparține în mod egal ambii atomi.
În cazul norului de comunicații electronice polare legături covalente mutat la atomul cu electronegativitate mai mare relativă. Un exemplu este molecula de compuși anorganici volatili: HCI, H2O, H2 S, NH3 și altele.
covalentă mecanism de formare a legăturii.
· Schimb - sunt implicate în legarea orbitali atomici cu un singur electron, adică fiecare atom prevede utilizarea generală a unui singur electron.
· Donor-acceptoare - formarea legăturii se produce datorită atomului donor de electroni pereche și orbitali vacante de atomi acceptor.
· Saturability - determinarea stoichiometria (compoziția cantitativă), compuși chimici moleculari.
Această caracteristică constă în faptul că fiecare atom se poate atașa doar un anumit număr de alți atomi. Astfel, în general, substanțele gazoase simple, constau din atomi 2: O2. Cl2. N2, etc.
· Orientare - determinarea structurii spațiale a moleculei (forma molecula). Directivitate depinde de: 1) - numărul de atomi în moleculă; 2) - tipul de interacțiune a norilor de electroni.
Molecule sunt următoarele forme:
· Triunghiulara - BCI3. AICI3 (plane);
In substanțe simple, molecule diatomice (H2. O2. Cl2 etc.) perechi de electroni, care formează legături covalente aparțin în mod egal ambelor atomi și, prin urmare, sunt în mijloc între centrele lor, adică norul de electroni totală simetric. Comunicarea în acest caz se numește un non-polare (covalentă).
14. Hibridizarea orbitali atomici.
Orbitali Hibridizarea - procesul de amestecare a diferitelor ipotetice (s, p, d, f) orbitalii atomului central al unei molecule poliatomic fără apariție a orbitali identice care sunt echivalente în caracteristicile lor.
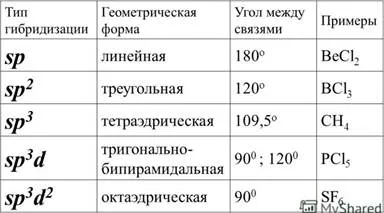
15. Structura compușilor complecși. Disocierea compușilor complecși. Constanta de disociere a compușilor complecși.
compus complex - particule formate ioni metalici încărcați pozitiv pot fi înconjurate de anioni sau molecule neutre.