Inhibitorii - Enciclopedia chimice
Inhibitorii (din mhibeo Latină - stop, restrânge), în insulele, împiedicând chimice. p-TION. Inhibarea lanțului de katalitich caracteristic și p-tiile, la- apar cu situri active sau particule active. Efectul inhibitor se datorează faptului că blochează AI siturile active de catalizator sau reacționează cu particulele active pentru a forma o activitate scăzută radical nu este capabil să continue lanțului. IA este administrat într-o concentrație mult mai mică decât concentrația în reacționând-in (10--10 la 2 - 5 mol%). Cinetica p-tiile care implică I. fundamental diferit de p-tiile catalitice și de lanț. În katalitich. p-TION a numărului de centre active, este fixat și I. blocarea o parte din ele nu se consumă în timpul procesului. Prin urmare, atunci când viteza de p-TION IM administrată este redusă, iar apoi procesul este lung. timp la o viteză constantă. În anumite cazuri, această rată poate crește lent, din cauza cheltuielilor pentru I. SUCESIUNE Incidentale p-TION. Particulele active ale lanțului de p-TION sunt generate în mod continuu, rezultând cheltuielile I. și auto-accelerare treptată a p-TION (în cazul cu catenă dreaptă p-TION restabilește în general viteza inițială).
Reacțiile în lanț Inhibarea. Durata efectului de frânare T numit GI. perioadă de inducție; numărul de lanțuri f. la- o molecula rupe I. unesc succesiv încetarea p-TION se numește. stoechiometric. coeficienți. inhibare. Când concentrația inițială I. [și] 0 și vi vitezei perioadă de inducție de inițiere a lanțului este: t = f [i] 0 / vi. Ex. chinonă inhibă polimerizarea monomerilor vinilici, care vine într-o urmă. p-TION:
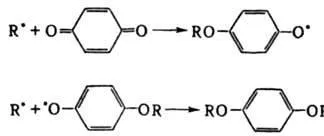
În acest caz, f = 2 și t = 2 [i] 0 / vi. În anumite sisteme, regenerarea are loc în lanț terminatorul țiilor p-VI, în care o moleculă de IV și care rezultă din acesta radical participă în mod repetat la rupere p-tiile. Ex. introducerea de ioni de cupru în lanț alcool izopropilic oxidat se taie, ca urmare a urmelor de curgere. alternativ p-tiile:
În astfel de sisteme, perioadele de inducție observate cu mult peste 2 [i] 0 / vi. Pentru fiecare p-TION există specificitate. Set I. p-TION hidrogenului cu clor și inhibă NCl3 O2. atomi de clor reactive; polimerizarea monomerilor vinilici -hinony, nitro, I2. Radicalii stabile (difenilpicrilhidrazil, radicali nitroxil) macroradicals alchil; purjați org de oxidare Port. (cauciucuri hidrocarbonați și poliolefine) fenoli, aromatice. amine, aminofenolilor, reacționează cu radicalii peroxid de RO2; olefine, cracarea hidrocarburilor și oxizilor de azot, care reacționează cu radicali alchil. Pentru a stinge arderea org comp. utilizare halocarburile CF3 Br, CF2 ClBr, C2 F4 Br2. Efectul lor de inhibare este cauzată de faptul că agentul de ramificare în timpul arderii sunt atomi de H, cu k rymi I. vin în p-TION: RBr + HBr Cauzele rezultate complementare. întreruperea lanțului de p-tsiyam:
(M - orice particulă treime). Pentru stingerea pulberilor de combustie de stingere sunt folosite (de ex. NaHCO3. Săruri fosfo de amoniu), la- au combinat cu. acțiune: reducerea concentrației de radicali datorită încetării lanț greu pe pansament și IFPS determina creșterea. un radiator (a se vedea. ardere). Distinge I. slabă și puternică Această p-TION. Este considerat un VI puternic la-ing, dacă este introdusă într-o concentrație ridicată este suficientă pentru a reduce unitatea de lungime a lanțului sau reduce viteza de p-TION în timpurile v0 / vi, unde v0 - viteza de referință r-TION. I. Lumina chiar și în concentrații introduse relativ ridicate reduce rata de p-TION a VI-cerned la o anumită valoare v> vi. Aceasta este cauzată de faptul că moleculele I. slab formate radicali capabile să continue lanț, în care raportul dintre v0 / v scade odată cu creșterea [ȘI] 0. atingând valori ale v0 / vi. AI are un efect inhibitor puternic într-o concentrație scăzută, numită. eficiente. I. Eficacitatea caracterizează valoarea derivatului -dV / d [I]. Ex. oxidarea hidrocarburilor în prezența RH. inițiator generând viteze de inițiere vi, este determinată de viteza de propagare a lanțului cu radicali peroxil:
astfel încât viteza inițială de oxidare a lanțului v = kp. [RH] []. Cele pres. I. ex. lanț fenol sunt tăiate de produse de tip p-TION. Condițiile cvasistationar de inițiere și terminare a ratei egală cu: vi = FKT [I] [RO2], prin urmare, [] = vi / FKT [I] și v = kp [RH] vi / FKT [I]. Eficiența inhibării se caracterizează prin raportul FKT / kp. Pentru inhibarea p-tiile cu catenă ramificată sunt caracterizate de critice. fenomene la ryh esență constă în scăderea bruscă a vitezei p-TION la foarte nesemnificative. creșterea concentrației I. Un exemplu este inhibată. autooxidare hidrocarburilor RH, într-un rom DOS. o sursă de radicali este un ROOH produs de oxidare. Atunci când un suficient de mare T-D sau în prezența. catalizator de conversie intens ROOH în radicalii RH oxidare poate continua într-un mod cvasistaționară când viteza de formare a ROOH practic egală cu rata de consum. pentru că Rata de formare a ROOH depinde de concentrația și concentrația de IA ROOH, acolo gât paradisul critic. concentrare IM la un roi de sistem inconstant se mută la regimul cvasistationar cu foarte mică (la 0,1-1%) concentrație schimbări I. Acest lucru duce la schimbări bruște în perioada de inducție a vitezei sau p-TION I. I. Două impuse reacționând sistemul poate spori reciproc efectul inhibitor al reciproc (așa numitul sinergism VI ..) sau de a diminua aceasta (antagonism VI); observate adesea efecte aditive două H. Dacă t 1 și t 2 - durata efectului inhibitor al primului și al doilea AI introdus separat și 12 t - durata acțiunii lor comune, în cazul sinergismului 12 t> (t 1 + t 2), în caz de antagonism t 12 <( t 1+ t 2 ). На диаграмме t - концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр. при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
Inhibarea reacțiilor catalitice eterogene efectuate în tine la- sunat. otrăvuri catalitice. Inhibarea p-TION cauzată de activitatea catalizatorului scădere datorită absorbției sale pe AI dressing-sti.
Inhibarea enzimatică m. B. reversibil și ireversibil. În ambele cazuri, I. capabilă să formeze un complex cu enzima, dar nu m. B. katalitich supus. cotitură și previne formarea enzimei - substrat. Ex. butanol inhibă hidroliza esterilor, catalizată de carboxipeptidază. Distinge următoare. cazuri de inhibiție reversibilă. inhibare competitivă directă la o moleculă de rom I. I S și substrat concurează pentru atașarea la centrul activ al enzimei E. Procedeul descris de (P - produs de reacție):
Cu un astfel de mecanism de inhibare, atunci când [E] <<[S]0 и Е <<[I]0. начальная скорость превращ. субстрата S равна:
inhibiția necompetitivă la un rom I. se alătură enzima activă sau complex enzimatic cu un substrat pentru a forma o formă inactivă catalitic:
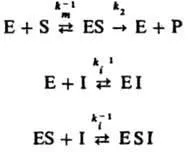
În acest caz, viteza inițială a p-TION este:
inhibiția necompetitivă, cu rom I. forme complexe inactive catalitic cu substrat:
Viteza inițială p-TION este:
Este de notat inhibând substratul enzimatic, enzimă inactivă formează un complex cu o a doua moleculă de substrat (inhibarea substratului). reacționând IV reacționează cu ireversibil enzima, dezactivare; Spre deosebire de inhibarea reversibilă a activității enzimei scade cu timpul.
Aplicație. Inhibarea este utilizat pe scară largă pentru a controla viteza de polimerizare prin radicali, în special în prepararea produselor de volum mare. I. oxidare este utilizat pentru stabilizarea poliolefinelor și cauciucuri în prelucrarea lor și condițiile de utilizare (a se vedea. Degradarea polimerilor), pentru stabilizarea lubrifianții și hidrocarburi combustibile pishch de conservare. grăsimi și lek. medicamente; în tehnologia de monomeri sunt folosite pentru a preveni oxida. polimerizare. In cercetarea I. folosit pentru a studia mecanismul de p-tiile de lanț funcționează, în special determinarea ratei de inițiere.
===
App. Literatura pentru „inhibitor“ al articolului: P. Ashmore cataliza și inhibarea reacțiilor chimice, per. din limba engleză. M. 1966; Inhibitorii L. Webb ai enzimelor și metabolism, trans. din limba engleză. M. 1966; Kuliev A. M. Chimia și tehnologia aditiv pentru uleiuri și combustibili, M. 1972 Denisov ET oxidarea Kovalev GI și stabilizarea combustibililor jet, M. 1983. ET Denisov.
Pagina „inhibitor“ preparat pe baza Encyclopedia chimice.