Hidrogenul din oțel, efectul hidrogenului asupra proprietăților oțelului
Solubilitatea sa în oțel și efectul hidrogenului asupra proprietăților oțelului. H2 se dizolvă în aliajele de oțel și fier în stare atomică (ionic). Atomii (ioni) de hidrogen, datorită dimensiunilor sale mici distribuite în spațiile libere dintre atomii de fier, creând soluții interstițiale.
Solubilitatea hidrogenului în fier poate fi descris prin ecuațiile:
Prin urmare, solubilitatea este proporțională cu rădăcina pătrată a presiunii acestuia. Acest model a fost stabilit Sieverts și apoi confirmată experimental M. M. Karnauhovym și A. N. Morozovym, VI Yavoyskim și alți cercetători. A fost totuși constatat că solubilitatea hidrogenului în oțelul depinde de temperatura și variază în mod discontinuu cu transformarea alotropică (valoare schimbare / KH).
Rezultatele cercetărilor prezentate sub forma isobars din Fig. 1 spectacol. că, odată cu creșterea temperaturii solubilității hidrogenului din oțel este în general crescută. În conversia unui-y-fier din fier, precum solubilitatea punctul de topire crește brusc hidrogen. În tranziția de la modificarea fierului în modificarea beta este oarecum redus.
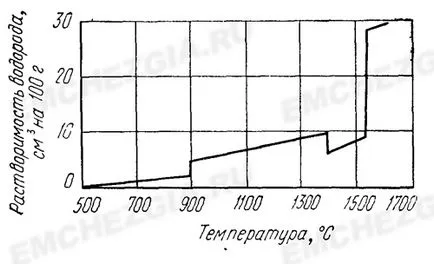
Alte elemente afectează solubilitatea hidrogenului din oțel. Acest efect este caracterizat prin parametrii de interacțiune.
În consecință, oxigen, siliciu și carbon inferior solubilitatea H2 în fier lichid, care acționează este deosebit de puternic de oxigen în această direcție. Titan, dimpotrivă, crește solubilitatea hidrogenului din oțel. Efectul altor elemente (Ni, Al, Cr, etc.). Neglijabila.
De o importanță deosebită este scăderea dramatică a solubilității H2 în oțel în timpul solidificării și reducerea în continuare a temperaturii. Fig. 1 arată că la 1600 ° C și pH2 = 10.223 kN / m 2 (760 mm Hg. V.), Solubilitatea hidrogenului din fier lichid este de aproximativ 28 cm3 per 100 g, iar fierul solid la temperatura camerei, este practic nulă . Prin urmare, în timpul cristalizării H2 continuă în mare parte în lichidul mumă, care determină segregarea puternică zonală în lingou, și după solidificare complet din soluție în metal.
Evoluția hidrogenului are loc în structură metalică și spațiul vid defect. Aici atomii H2 se combină pentru a forma molecule, și merge într-o stare gazoasă.
Dacă volumul gol este suficient de mare, așa cum este cazul în metalul turnat, presiunea H2 în ei mari și influența hidrogenului asupra proprietăților de oțel nu sunt semnificativ. Dacă volumul gol este mic (de exemplu, un metal laminate și forjate) hidrogen trece doar micropori și locurile cu zăbrele defecte în cazul în care există o presiune ridicată (până la 1 kN / m2 sau 100 kgf / mm2), afectând în mod negativ proprietățile oțelului.