Ghid rapid de calciu, alcalinitate, magneziu și pH
Ghid rapid: calciu, alcalinitatea, pH-ul și Mg
Excesiv descriere simplificată a interacțiunii dintre acești parametri este mai ușor, dar uneori complica înțelegere. Din păcate, simplificarea inexacte de multe ori duce la concluzii incorecte. Deci, noțiune prea simplist că concentrația totală de calciu și alcalinitate, care poate fi permanentă în apa de mare, au o limită superioară comună poate duce la interpretări greșite.
De exemplu, sunt adesea întrebat întrebări cum ar fi:
Ce e mai rău, acest tip de concepții greșite poate duce la ceea ce unii acvaristi au abandonat pur si simplu incercarile lor de a înțelege procesele chimice care au loc în acvariu; o interpretare simplificată de multe ori duce la concluzii incorecte falsitate, care este evidentă chiar și din punctul de vedere al practicii.
Calciul - este unul dintre cele mai importante ionii de apă de mare. Concentrația sa în apa de mare normală este de aproximativ 420 ppm. astfel, de calciu este mai mică de 1,2% în greutate, în greutate de solide de apă de mare. În ocean, această concentrație modificări sunt de obicei datorită modificărilor salinitate, respectiv, modificări ale nivelurilor de salinitate a apei napryamuyusvyazany concentrației calciului. În apa de mare, ionul de calciu poartă două sarcini pozitive notate de Ca ++.
Calciul recif akariume joacă un rol important, deoarece multe organisme, inclusiv corali și alge coraline, folosindu-l pentru a forma baza. niveluri insuficiente de cauze de calciu dăuna activității vitale a acestor organisme, ele pot chiar să moară. Vă recomandăm menținerea concentrației de calciu în acvariu recif la nivelul de 380-450 ppm.
Alcalinitatea - este de figura complexă. Acest lucru - nu „chestii“ care este prezent în apă. Alcalinitatea este un agregat de mai multe substanțe care furnizează proprietăți chimice specifice. Motivul pentru măsurarea hobbyists alcalinitate este că, în apa de mare normală, constă în principal din carbonat și bicarbonat. Coralii consuma bicarbonat (HCO 3 -) și transformarea acesteia într-un carbonat (CO 3 -) este necesar pentru formarea scheletului. Prin urmare, este o alcalinitate indicație suficientă sau insuficientă, conținutul de bicarbonat.
nivelurile de alcalinitate în intervalul normal, sau mai mare, dovada de conținut suficient de bicarbonat, în timp ce cea mai mică rată spune despre lipsa de bicarbonat în apă. În absența unor aditivi speciali pentru a menține nivelul de alcalinitate în bicarbonat de resurse acvariu recif în apă epuizat rapid. In acvarii separate pentru recif declin alcalinitate de la normal la un nivel inacceptabil de scăzut poate dura cât mai puțin una sau două zile, deși în acvarii cu mai puțin carbonat de nevoie în acest proces va fi mai lung. Ca epuizarea bicarbonatului de resurse în coralii de apă consuma este lipsită de substanță necesară pentru traiul lor, și poate chiar să moară. Recomand urvoen acvariu mentine alcalinitatea in cadrul 2,5-4 mEq / L (7-11 dKH. Ceea ce este echivalent cu 125-200 ppm de carbonat de calciu).
Deoarece multe corali, alge de coral și alte organisme calcifia necesită calciu și mediu alcalin (bicarbonat), ar trebui să se mențină concentrația dorită a acestor elemente. Din păcate, există o tendință naturală de precipitarea carbonatului de calciu insolubil la un (non-biologic) nămolul abiotic ca ionii de calciu și ioni carbonați sunt combinate. O astfel de tendință de precipitare joacă un rol important în interacțiunea concentrației calciului și alcalinitatea din acvariu recif.
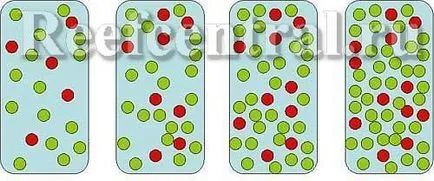
Înainte de a discuta solubilitatea și precipitarea, precipitarea unui compus, cum ar fi carbonat de calciu, ia în considerare un caz simplu. De exemplu, ionii de sodiu și clorura sunt combinate pentru a forma un solid - clorură de sodiu (sare de masă). Imaginați-vă dacă bucata mai mică de clorură de sodiu în apă proaspătă (Figura 1). Este solubil în măsura în care ionii lăsând suprafața (Figura 2).
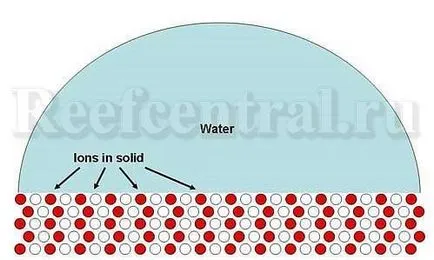
Figura 1. Diagrama de solid simplu (clorură de sodiu) în apă. Ionii de sodiu (roșu) și clorură de (albe) formează o structură ordonată a unui solid.
Figura 6. Reprezentarea grafică a concentrației relative de ioni bicarbonat (verde) și carbonat (culoare roșie) în soluție în funcție de nivelul pH-ului. Odată cu creșterea pH-ului, creșterea cantității de ioni din numărul total este reprezentat ca un carbonat. Valoarea relativă reprezintă raportul dintre cei doi ioni la diferite niveluri ale pH-ului (alcalinitate este crescută deoarece un nivel de ioni de carbonat de alcalinitate asigură un dublu față de ion bicarbonat).
Astfel, după cum se schimbă nivelul pH-ului, astfel încât nu concentrația de ioni de carbonat în soluție. Deoarece este concentrația de ioni de carbonat afectează scăderea ionilor de carbonat de pe suprafața nivelului, deci cu o creștere a pH-ului, carbonat se va scufunda la suprafață mai repede. Aceasta înseamnă, la rândul său, cu cât pH-ul, inferior solubilitatea carbonatului de calciu.
solubilitate scăzută înseamnă că precipitarea carbonatului de calciu sub forma unui precipitat poate fi mai intens la un pH mai mare. Cu alte cuvinte, prin creșterea pH-ului, concentrația de calciu și alcaline, care pot fi prezente în soluție, fără scăderi de precipitații.
Acest lucru explică, de exemplu, de ce o creștere a pH-ului la niveluri ridicate folosind calcaroasa bysro poate facilita precipitarea carbonatului de calciu precipitat. Acest lucru se datorează nu faptului că apa de var adauga o cantitate semnificativa de calciu sau de alcalii, deși acesta poate juca un rol precum pH-ul crește, și o mare parte din apa prezentă în hidrogen sub formă de carbonat intră, și concentrația crește carbonat.
In schimb, la scăderea nivelului pH-ului de calciu și alcaline, care pot fi prezente în soluție, fără a crește precipitațiile. Acest efect se explică, de exemplu, de ce o scădere a pH-ului, folosind dioxid de carbon poate dizolva carbonatul de calciu în reacția dioxidului de carbonat de calciu / carbon. La pH 6,5 concentrație de carbonat de 50 de ori mai mică decât nivelul la rN8.2; Viteza de coborâre, astfel de ioni de carbonat este redus semnificativ. Această reducere a vitezei permite mai mult carbonat de calciu dizolvat în apă înainte de starea de saturație, atunci când procesul de dizolvare se oprește.
Acest efect este, de asemenea, conectat cu o regularitate care poate confunda de multe acvaristi. La un pH scăzut (de exemplu, 7,8) în soluție poate menține un nivel ridicat de calciu și alcalinitate decât la pH mai mare (de exemplu, 8,5). Din acest motiv, pasionaților, în acvarii al căror pH scăzut, spun de multe ori nu au nici o problema de a menține un nivel ridicat de calciu și alcalinitate, iar acestea sunt rareori îndepărtate prin decantare carbonat de calciu din pompă, în timp ce pasionaților, sprijinind un pH mai mare. Ei nu înțeleg de ce nu pot crea condițiile în acvariu, și de ce atât de des bloca pompe. Principalul motiv pentru această diferență constă în cea mai mare concentrație de carbonat la niveluri ridicate ale pH-ului (un alt motiv poate fi faptul că consumă cantități mari de calciu coral si alcalinitate mai la niveluri mai ridicate ale pH-ului, deoarece la valori ridicate ale pH-ului corali se pot solidifica mai rapid). Cu toate acestea, nu cred că un nivel scăzut pH-ului este mai bine, deoarece este mai ușor să se mențină nivelul de calciu și alcalinitate, și pompe mai lent saboți. Rata scăzută este stresant pentru corali pentru motivul că acestea trebuie să fie întărit la pH scăzut. Dificultatea aici este că corali trebuie să pompa de protoni (H +) în timpul producerii de carbonat acid, și scade pH-ul, mai mult H + este prezent în soluție, și cu atât mai dificil de a pompa exces H +.
Solubilitatea carbonatului de calciu este, de asemenea, depinde de alcalinitatea apei. Nivelul ridicat de alcalinitate (pH la un nivel constant), cu cât concentrația de carbonat (Figura 7). De fapt, nivelul de carbonat este direct proporțional cu nivelul de alcalinitate. Astfel, atunci când nivelul de alcalinitate egală cu 5 mEq / L (14 dKH), concentrația de carbonat de două ori mai mare decât în apa de mare normala la nivelul alcalinității 2,5 mEq / L (7 dKH).