Entropia este ușor!
Acest post este o traducere liberă a răspunsului pe care Mark Eichenlaub a dat întrebarea Ce este un mod intuitiv de a înțelege entropie?. specificat pe site-ul Quora
Entropia. Poate că aceasta este una dintre cele mai dificile de înțeles concepte, cu care se pot întâlni în cursul fizicii, cel puțin atunci când vine vorba de fizica clasică. Puține facultăți fizice absolvenți pot explica ce este. Cele mai multe dintre problemele cu înțelegerea entropiei, cu toate acestea, pot fi eliminate, dacă înțelegeți un lucru. Entropia este calitativ diferit de celelalte mărimi termodinamice: cum ar fi presiunea, volumul, sau energie internă, pentru că nu este o proprietate a sistemului, și modul în care ne uităm la acest sistem. Din păcate, în cursul termodinamicii este de obicei tratată pe picior de egalitate cu alte funcții termodinamice, ceea ce contribuie la neînțelegere.
Deci, ce este entropia?
Într-un cuvânt,
Entropia - asta e modul în care o mulțime de informații nu știți despre sistemul
Și dacă ți-am spus că suma este egală cu 59? Pentru acest macrostări există doar 10 microstări posibile, astfel încât entropia lui este doar un singur caracter. După cum puteți vedea, diferite au diferite entropie macrostări.
Acum, să vă spun că suma primelor cinci oase 13, iar suma rămasă de cinci - 17, astfel încât cantitatea totală de peste 30. Trebuie, cu toate acestea, în acest caz, mai multe informații sunt disponibile, astfel încât entropia sistemului pentru tine ar trebui să scadă. Și, într-adevăr, 13 în cinci oase pot obține 420 mii în moduri diferite, și 17-780-lea, adică, numărul total de microstările pentru o simplă 420h780 = 327 600. Entropia unui astfel de sistem este de aproximativ un caracter mai puțin decât în primul exemplu.
Măsurăm entropia numărul de caractere necesare pentru a înregistra numărul de microstările. Matematic, aceasta este definită ca logaritmul numărului, astfel încât simbolul care indică entropia S, iar numărul de simbol al microstări w, putem scrie:
Acest lucru nu este altceva decât formula Boltzmann (până la un factor k, care depinde de unitatea selectată de măsurare) pentru entropiei. Dacă macrostări întâlni o microstare, entropia lui prin această formulă este zero. Dacă aveți două sisteme, entropia totală este egală cu suma entropia fiecăruia dintre aceste sisteme, deoarece log (AB) = log A + B log

Din descrierea de mai sus a rezultat devine clar de ce nu trebuie să ne gândim la entropie ca lor sisteme de proprietate proprii. Sistemul are opedelonnye interne de energie, impuls, taxa, dar nu are o anumită entropie: entropie zece oase depinde de cunoscut numai pentru tine suma totală, sau de asemenea, sumele parțiale oasele cinciarii.
Cu alte cuvinte, entropia - care este modul în care vom descrie sistemul. Și o face mult mai diferit de alte cantități, care a făcut de lucru în fizica.
exemplu fizică: gazul sub pistonul
Sistemul clasic fiind tratate în fizică, este gazul conținut în vasul de sub pistonul. gaz microstare - această poziție și impuls (viteza) a fiecăreia dintre moleculele sale. Acest lucru este echivalent cu faptul că știi sensul că a căzut pe fiecare os din exemplul nostru mai devreme. gaz macrostări este descris asemenea cantități ca presiunea, densitatea, volumul, compoziția chimică. Aceasta este suma valorilor de pe zarurile aruncate.
Cantitățile care descriu macrostări pot fi legați unul de celălalt printr-o așa-numită „ecuația de stare“. Prezența acestei conexiuni permite, să nu știe microstările pentru a anticipa ce se va întâmpla cu sistemul nostru, dacă începeți-l să se încălzească sau să se miște pistonul. Pentru o ecuație de gaz ideal de stat este simplu:
Cu toate că sunt susceptibile de a fi mai familiarizați cu Clapeyron - Mendeleev pV = νRT - aceasta este aceeași ecuație, cu adăugarea unei perechi de constante, pentru a te confunda. Cu cat mai multe microstările care corespund unui anumit macrostări, adică mai multe particule fac parte din sistemul nostru, cu atât mai bine starea ecuației îl descrie. Pentru valorile tipice ale numărului de particule de gaz sunt numarul lui Avogadro, adică de ordinul din 23 octombrie.
Valorile de presiune tip, temperatură și densitate se numește medie ca sunt manifestarea medie continuu microstările succesive corespunzătoare acestei macrostări (sau mai degrabă aproape de ea macrostări). Pentru a afla microstare în care se află sistemul, avem o mulțime de informații - trebuie să știm poziția și viteza fiecărei particule. Valoarea acestor informații se numește entropie.
Cum se schimbă în entropia unui macrostări? Este ușor de înțeles. De exemplu, dacă avem un pic de căldură gazul, acesta va crește viteza particulelor, prin urmare, va crește gradul de ignoranta noastre despre viteza, adică, creșterea entropiei. Sau, dacă vom crește volumul de gaz prin împingerea pistonului pentru a mări gradul de ignoranța noastră pozițiile particulelor, și entropia, de asemenea, să crească.
Solide și energie potențială
Dacă luăm în considerare în loc de gaz orice corp solid, mai ales cu o structură ordonată în formă de cristale, de exemplu, o bucată de metal, entropia lui este scăzută. De ce? Deoarece cunoașterea poziției atomilor într-o astfel de structură, și știți poziția tuturor celorlalți (acestea sunt aliniate în structura cristalină corectă), viteza de atomi este mică, pentru că ei nu pot zbura departe de poziția lor și doar ușor oscila în jurul poziției de echilibru.
În cazul în care o bucată de metal se află în câmpul gravitațional (de exemplu, a ridicat deasupra suprafeței), energia potențială a fiecărui atom din metal este aproximativ egală cu energia potențială a altor atomi, și sunt asociate cu această energie entropie joasă. Aceasta deosebește energia potențială de energie cinetică, care pentru mișcarea termică poate varia de la atom la atom.
În cazul în care o bucată de metal, a ridicat la o anumită înălțime, da drumul, atunci energia potențială este transformată în energie cinetică, dar entropia crește aproape nu vor, pentru că toți atomii se vor deplasa aproximativ același. Dar când o piesă cade la pământ în timpul impactului atomii de metal pentru a primi o direcție aleatoare, iar entropia creste in mod dramatic. Energia cinetică a mișcării dirijate merge în energia cinetică a mișcării termice. Înainte de a lovit unele știm cum fiecare atom se mișcă, acum am pierdut aceste informații.
Înțelegem a doua lege a termodinamicii
A doua lege a termodinamicii spune că entropia (sistem închis) crește mereu. Acum putem înțelege de ce: pentru că nu se poate obține dintr-o dată mai multe informații despre microstările. De îndată ce vă veți pierde unele informații despre microstare (atât în timpul impactului o bucată de metal de pe teren), nu poți aduce înapoi.

Să ne întoarcem la zarurile. Să ne amintim că macrostării cu suma de 59 are o entropie foarte scăzută, dar, de asemenea, obține nu este atât de ușor. Dacă arunci zarurile peste si peste din nou, ei vor cădea din sumele (macrostări), care corespund unui număr mai mare de microstările, care urmează să fie pus în aplicare cu mare entropie macrostări. Cea mai mare Entropia are un total de 35, și că va scădea mai mult decât altele. Asta e despre asta, și a doua lege a termodinamicii. Orice interacțiune aleatoare (necontrolată) conduce la o creștere a entropiei, cel puțin până când se ajunge la maxim.
amestecarea gazelor
Și încă un exemplu pentru a remedia spus. Să presupunem că avem un container în care există două gaze, separate printr-un perete despărțitor situat în mijlocul recipientului. Să ne numim o singură moleculă de gaz albastru, iar celălalt - roșu.
Dacă deschideți partiția, gazul va începe să se agite, deoarece numărul de microstările în care sunt amestecate gazele, mult mai mult decât microstările în care acestea sunt separate, și toate microstările, desigur, în mod egal. Când am deschis partiția, ne-am pierdut informațiile de care parte a peretelui despărțitor este acum pentru fiecare moleculă. Dacă moleculele au fost N, N-au pierdut biții de informație (biți sau simboluri aici, aceasta este de fapt același, și diferă numai printr-un factor constant).
Înțelegem cu demonul lui Maxwell
Și, în sfârșit, să ia în considerare soluția ca parte a paradigmei noastre de celebrul paradox al demon al lui Maxwell. Permiteți-mi să vă reamintesc că este după cum urmează. Să avem gaze amestecate din moleculele albastre și roșii. Pune înapoi partiție, după ce a făcut în ea o mică gaură, în care planta daemon imaginar. Sarcina lui - pentru a trece de la stânga la dreapta doar roșu și albastru de la dreapta la stânga numai. Este evident că, după un timp, gazele sunt divizate din nou: toate moleculele albastre vor fi lăsate de pereți, și toate roșu - pe dreapta.
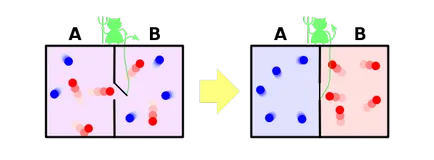
Se pare că demonul a redus de entropie a sistemului. Din moment ce nu sa întâmplat nimic demon, adică entropia lui nu sa schimbat, dar sistemul a fost închis în țara noastră. Se pare că am găsit un exemplu în cazul în care a doua lege a termodinamicii nu este îndeplinită! După cum este dovedit a fi posibil?
Noi rezolva acest paradox, cu toate acestea, este foarte simplu. După entropie - această proprietate nu este un sistem, și cunoștințele noastre despre sistem. Știm cu toții despre sistemul este mic, și așa credem că entropia scade. Dar daemon nostru știe despre sistemul mult - la molecule diferite, el trebuie să cunoască poziția și viteza fiecăreia dintre ele (cel puțin se apropie de ea). Dacă el este conștient de toate moleculele, că din punctul său de vedere, entropia sistemului, de fapt, este zero - nu are informațiile lipsă cu privire la aceasta. În acest caz, deoarece entropia sistemului a fost egal cu zero și rămâne la zero, iar cea de a doua lege a termodinamicii nu a deranjat.
Dar chiar dacă demonul nu cunoaște toate informațiile despre microstarea sistemului, este, cel puțin, este necesar să se cunoască culoarea moleculei zboară până la el să înțeleagă, să-l treacă sau nu. Și în cazul în care numărul total de molecule este N, demonul trebuie să aibă N biți de informații despre sistemul - dar este atât de multe informații și ne-am pierdut atunci când este deschis partiție. Aceasta este, cantitatea de informație pierdută este exact egală cu cantitatea de informații care urmează să fie obținute cu privire la sistemul pentru a reveni la starea inițială - și acest lucru sună destul de logic, și, din nou, nu este contrar a doua lege a termodinamicii.