echilibru chimic Oia
chimice de stat. echilibru - o stare în care produsele de pornire și him.potentsial în egal, ținând cont de stoechiometria procesului.
Pe de echilibru chimic se poate vorbi în două condiții:
Viteza de deplasare înainte și înapoi reacțiile sunt egale.
există Equilibrium dacă presiunea externă, atunci când scoateți sistemul revine la starea inițială.
acțiune de masă 11.Zakon.
La o temperatură constantă, viteza de reacție chimică este direct proporțională cu produsul dintre concentrațiile reactanților, luate în grade, egal cu coeficienții stoechiometrici în ecuația reacției.
De exemplu, pentru reacția de sinteză a amoniacului:
dreptul de acțiune în masă este după cum urmează:
12.Konstanta de echilibru într-un sistem omogen. Modalități de exprimare a constanta de echilibru.
echilibru constant - este o constantă egală cu raportul dintre concentrațiile de echilibru ale produselor finite și de pornire al reactanților, combinate într-un grad corespunzător coeficienților stoichiometrice
Chemat reacții omogene într-o singură fază: un amestec de gaze în formă lichidă sau în soluție solidă, uneori.
Moduri de exprimare constanta de echilibru
În cazul în care concentrațiile substanțelor implicate în reacție, exprimată în unități molare de molaritate. și anume în mol / l, este de obicei denumit Kc
Pentru reacția de gaz omogen echilibru constant mai convenabil exprimat în termeni de presiune parțială a substanțelor:
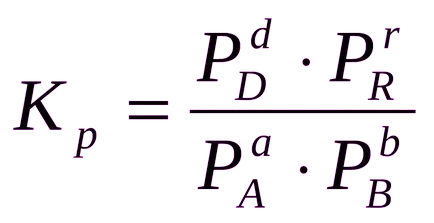
Uneori este convenabil de a exprima constanta de echilibru nu este în termeni de presiune parțială și concentrare, precum și un număr de substanțe:
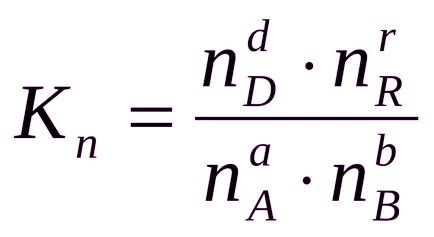
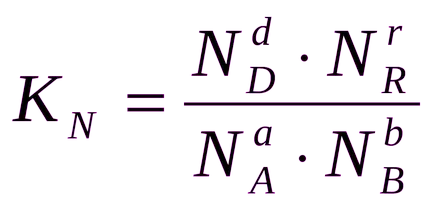
În general, echilibru Ks constante, Kp și Kn sunt RN diferite.
în cazul în care sistemul este în echilibru, este o acțiune externă, echilibrul se schimbă în direcția în care reduce influența externă.
isobars 14.Uravnenie van't Hoff.
această expresie poate evalua calitativ impactul T asupra constantei de echilibru și de echilibru.
Faza numit - o parte omogenă a unui sistem eterogen, care are o interfață reală, în care toate proprietățile pot varia în mod continuu, dar în timpul tranziției prin care un salt.
substanțe și componente 16.Sostavlyayuschie.
Componenta se numește - numărul minim de componente în în suficientă pentru a descrie sistemele de stat.
Componentele Veschestvaminazyvayutsya - substanțe care alcătuiesc sistemul, care pot fi recuperate prin tehnici de preparare convenționale și care pot exista în afara sistemului pe termen nelimitat.
Gradele de libertate ale echilibrului termodinamic al sistemului, din care numai factorii externi de temperatură și presiune care afectează, numărul de componente independente este egală cu C = R-F + n (numărul de parametri externi)
regula fază arată că numărul de grade de libertate crește odată cu numărul de componente și scade odată cu creșterea numărului de faze ale sistemului.
18.Usloviya fazei de echilibru în sistem.
Într-un sistem eterogen are un echilibru de fază, dacă următoarele tipuri de echilibre între faze:
(temperaturi de egalitate) termice
Mecanică (presiune egală)
Chimice pentru fiecare componentă
în care, volumul -ΔV- substanță schimbare la tranziția de la prima fază la a doua T - temperatura de tranziție, AH - variația entropiei și entalpie substanței în tranziția de 1 mol dintr-o substanță de la o etapă la alta
Aceasta permite să se evalueze modul în care temperatura sau presiunea în timpul tranziției de fază la schimbarea parametrului 2.
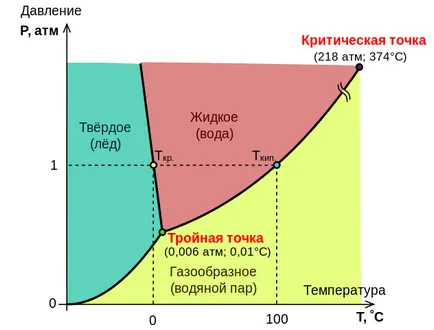
20. Diagrama de stare a apei
Relația dintre cantitățile ce caracterizează starea sistemului și schimbările de fază în tranziția sistemului de la solid la lichid, de la lichid la gaz
soluții 21.Istinnye. Metode de exprimare soluție de concentrație. Calcularea masei și molara molară proporția de substanță și concentrația substanței în soluție.
O soluție adevărată - un fel de soluție, în care dimensiunile particulelor de solut sunt extrem de mici și comparabile cu dimensiunea particulelor solventului.
Soluțiile sunt itverdye gaz (amestec gazos) lichid. soluție gazoasa este aerul. Seawater - un amestec de săruri în apă - soluție lichidă. Soluțiile solide - aliaje metalice. Soluțiile constau din solut (e) și solvent.
Soluție numit sistem omogen solid sau lichid, care constă din două sau mai multe componente.
Solventul este considerat - în definirea stării fizice a soluției sau a căror sunt mai mari în volum sau în greutate.
Metode de concentrare a soluțiilor de exprimare.
Concentrația soluției - este greutatea sau numărul de solut într-o cantitate specifică, greutatea sau volumul soluției sau solvent.
1) fracție Greutate (wi) - este masa solutului conținută în 100 g de soluție.
3) molal concentrare (molalitate) Ml - numărul de moli de solut conținute în 1 kg de solvent [mol / kg].