Determinarea greutății moleculare nonelectrolyte Metoda cryoscopic
Soluția se numește un sistem monofazic format din cel puțin două componente și este capabil de o anumită măsură la schimbarea continuă a compoziției. Cu toate acestea, unele proprietăți ale soluției sunt modificate, schimbarea nu depinde de natura solutului și concentrația independent solut structurii sale chimice. Acest lucru indică faptul că solutului nu reacționează cu solventul. Astfel de proprietăți sunt numite soluție coligative (cuvântul „Collegiate“ ( „collig“ - colegi) înseamnă „legate unele de altele“), în funcție de numărul particulelor de solut. Printre acestea se numără:
· Scăderea presiunii de vapori a vaporilor saturați deasupra soluției;
· Creșterea punctului de fierbere a soluției - ebullioscope;
· Scăderea punctului de congelare al soluției - cryoscopy;
Principalele dintre ele este scăderea presiunii de vapori, iar celelalte trei proprietăți sunt derivate din aceasta, ca o consecință.
Deoarece proprietățile coligative depind de numărul de particule dizolvate, aceasta permite definirea acestora substanțele în masă molare, dintre care cea mai exactă este o metodă cryoscopic. Metoda Cryoscopic se numește o metodă de determinare masa molară a substanței pentru scăderea temperaturii de congelare, a fost soluția diluată în raport cu solventul pur.
Metoda Cryoscopic este utilizată pentru a determina un număr de constante fizice și chimice ale substanței dizolvate, precum și pentru studierea proprietăților soluțiilor și fluide biologice (sânge, suc gastric, fluid cerebrospinal, urină, etc.).
Pentru soluțiile de non-electroliti metoda cryoscopic poate determina masa molară a substanței dizolvate, pentru soluții electrolitice și fluide biologice - osmolaritate și osmolalitatea pentru soluții diluate de electroliți - gradul de disociere, și, prin urmare, constanta de disociere a solutului.
Studiile fizico-chimice au aratat ca depresia (congelare punctul deprimare) se caracterizează prin constanță semnificativă sânge uman: limitele fluctuațiilor normale ale valorilor depresiei este 0,55-0,58 °. Amploarea depresiei 0,59 ° puncte deja pe abaterea de la normă, și 0.60 a patologiei. Valoarea durabilă sângele depresiei indică constanța osmolarității sale. Diferența dintre venoasă și depresie arteriale de 0,01-0,02 ° și depinde de gradul de îmbogățire a dioxidului de carbon din sânge venos și alte produse metabolice.
valori anormal de ridicate ale circulației sanguine de depresie observate în tulburări ale inimii, plămânilor, boli de rinichi și, în caz de încălcare a sistemului nervos. Anormal depresia poate fi scăzută în timpul sarcinii și intoxicație severă.
Indicații depresie urină variază într-un interval larg de la 0,1 la 3,5 °.
Precizia și ușurința metodei cryoscopic face posibilă utilizarea în practica clinică.
Conform legii lui Raoult vaporii de solvent de mai sus soluție P1 la orice temperatură T este egală cu presiunea de vapori a solventului pur P1 °, înmulțită cu fracția molară de solvent în soluție, adică,
Aceasta implică o serie de consecințe importante:
1 consecință - legea krisoskopichesky: temperatura de congelare a soluției solide este întotdeauna sub punctul de îngheț al solventului pur, cu condiția că este însoțită de înghețare eliberarea de soluție de solvent solid pur (a se vedea figura 1 ..):
în cazul în care Dtzam. și # 916; Tzam - o schimbare în scăderea punctului de congelare a soluției în comparație cu solvent, exprimată în grade Celsius și Kelvin, respectiv.
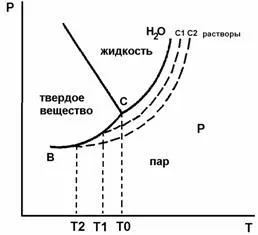
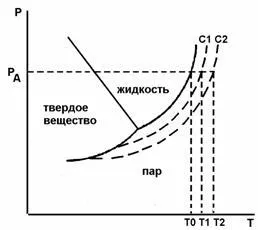
Fig.1. Faza de apă diagramă și soluții cu concentrații de C1 și C2 (cryoscopy), T0. T1. temperaturi de inghet - T2
Fig.2. Diagrama de stare și soluție de apă cu o concentrație de C1 și C2 (ebulliskopiya) T0. T1. T2 - punctul de fierbere
Cu cât este mai concentrat soluția, cu atât mai mare scăderea presiunii vaporilor deasupra soluției, cu atât mai mare trebuie să fie # 916; Tzam. prin urmare
unde K - constanta cryoscopic, Cm - concentrația soluției în solvent mol / 1 kg (concentrație molal).
solvent pur și soluția datorită declanșării dificultăților de cristalizare tind să SuperCool, care poate fi de 1-2 ° C în comparație cu adevărata tzam. Cu agitare viguroasă, lichidul suprarăcit începe să se cristalizeze solventul și temperatura este crescută prin emisia de căldură de cristalizare. Temperaturile maxime observate în cristalizarea solventului pur și solvent din soluție este luată ca punctul de congelare al solventului pur și soluția, respectiv.
Coeficientul K pentru fiecare solvent este o valoare constantă numită de scădere a punctului de congelare molar sau constanta cryoscopic. Valoarea numerică a K este # 916; tzam. . unde Cm este egal cu 1 mol per 1 kg de solvent (soluție de odnomolyalny).
Corolar 2 - legea ebullioskopichesky: soluție solidă de temperatură este întotdeauna de fierbere peste punctul de fierbere al solventului pur la aceeași presiune.
Ebullioskopiya - crește punctul de fierbere al soluției, în comparație cu solventul pur (a se vedea figura 2 ..):
unde Cm -. concentrația soluției în mol / 1000 g solvent (concentrația molal), E - constanta ebulioskopicheskaya. Ebullioskopicheskaya constantă egală cu modificarea odnomolyalnogo punct al soluției de fierbere în comparație cu solvent.
3 sledstvie.Osmos - fenomenul de tranziție unilaterală a moleculelor de solvent în soluție prin membrana semipermeabilă poroasă (membrană) la o concentrație mai mare de solut. Se numește presiunea osmotică a cea mai mică presiune care urmează să fie aplicată la o soluție pentru a preveni curgerea solventului prin membrană în soluție cu o concentrație mai mare a substanței.
molecule de solvent cum ar fi molecula de oricare dintre forta conducatoare care apar din cauza diferenței de potențial chimic. Atunci când o substanță este dizolvată, potențialul chimic al solventului redus. Prin urmare, în regiunea în care concentrația solutului deasupra potențialului chimic al solventului de mai jos. Astfel, moleculele de solvent se deplasează din soluție într-o soluție cu o concentrație mai mare, se deplasează în sens termodinamic, „jos“, „pe gradientul“.
În soluții care conțin un amestec de electroliți, cum ar fi soluții, includ toate lichidul biologic, calcularea numărului de particule independente cinetic împiedicată. În acest sens, medicamentul utilizat concepte, cum ar fi osmolalitatea și osmolaritatea.
Sub osomlyarnostyu (și osmolalitatea) înseamnă concentrația de particule active, care nu penetrează prin idealul membrana semipermeabila. măsurătorile Unitățile osmolaritate coincid cu concentrația molară a unităților și osmolalitatea - concentrația molal. Pentru soluții diluate se poate presupune că valorile numerice ale osmolalitatea și osmolaritatea la fel. De fapt, osmolalitatea și osmolaritatea este definit matematic ca, respectiv, sunt valori empirice, a căror utilizare face posibilă să se țină seama de natura diferită a abaterii de la legea lui Raoult care apar în cazul soluțiilor non-ideale.
Presiunea osmotică a sângelui depinde de concentrația plasmatică a soluți moleculare (electroliți și non-electroliți) și reprezintă cantitatea de ingredient al presiunii osmotice conținute de acesta. Presiunea osmotică a sângelui. proteina produsa de sange numita presiune oncotică. Astfel, mai mult de 60% din presiunea osmotică clorurii de sodiu este generată și doar o fracțiune de electroliți anorganici scade la 96% din presiunea osmotică. Presiunea osmotică este una dintre constanta homeostatice rigid și este o persoană sănătoasă medie 7.6 atm cu un interval posibil de oscilații 7,3-8,0 atm. În cazul în care mediul intern al unei soluții lichide sau artificial preparată are aceeași presiune osmotică ca sângele normal de plasmă, similar cu mediul lichid sau soluția numită izotonică. Prin urmare, un lichid cu o presiune osmotică ridicată este numită hipertensiune esențială. și mai mici - hipotonic.
Presiunea osmotică poate fi calculată folosind legea van't Hoff:
unde SM - concentrația soluției în soluție mol / L (concentrația molară), R - este constanta universală a gazelor. T - este temperatură, K.
Toate dependențele discutate mai sus sunt aplicabile numai soluțiile diluate de non-electroliti.
Obiectiv: Pentru a determina greutatea moleculară a metodei de glucoza depresie punct de congelare.
Ø Dispozitiv pentru măsurarea punctului de congelare depresie
echilibru Ø Laborator
Ø sticlă de 150 ml (sau flacon)
Ø scala termometru intervalul 0,1 ° C
Ø răcirea amestecului (gheață și sare)
Ø Apă distilată
Rezumatul aparatului - cilindrul (sau tub), care de deschidere superioară este închisă ermetic închisă. Tubul este întărită termometru măsurarea temperaturii fluidului introdus în cilindru. De asemenea, trece prin dopul agitatorului sârmă subțire. Capătul inferior al agitatorului este îndoit sub forma unui inel care acoperă în mod liber partea inferioară a termometrului.
Cilindrul este plasat într-un pahar cu perete gros, cu un capac umplut cu un amestec de răcire. Amestecul rece a fost agitat cu un agitator din sârmă groasă.
Pentru a obține rezultate mai precise în timpul cilindrului de măsurare este recomandat să nu pună în mod direct într-un amestec de răcire, iar în cilindrul mai larg. Astfel, între amestecul de răcire și cilindrul cu mantaua de airbag soluția de testat este creat, care asigură o răcire mai uniformă.
Experiența №1. Măsurarea temperaturii de congelare a solventului
1. Se prepară un amestec de răcire de gheață și sare. Temperatura amestecului de agent frigorific trebuie să varieze între -7 la -5 ° C Dacă este necesar, se ajustează prin adăugarea de câteva cuburi de gheață, în cazul în care temperatura este sub -7 ° C sau un amestec de stropire sare la temperaturi de peste -5 ° C Se introduce amestecul lichid de răcire al unui pahar.
2. Cilindrul se toarnă 70 ml apă distilată. Puneți-l într-un amestec de răcire, astupate cu un agitator, un termometru montat în acesta. Nivelul apei din cilindru trebuie să fie 0.5-1 cm deasupra nivelului rezervorului de mercur, un rezervor de mercur trebuie să fie amplasat în interiorul mixer inel.
3. Apa a fost agitată puternic în cilindru, pentru a evita depunerea de gheață pe pereții cilindrilor.
De obicei, sub apă de răcire treptată rămâne lichid la o temperatură ușor sub zero grade. Apoi, după atingerea unui anumit cristalizare temperatură începe brusc pe tot parcursul. Temperatura se ridică brusc la 0 ° C și rămâne constantă în timpul cristalizării.
Cu agitare continuă, monitorizarea coborârea mercurului în capilar. La o anumită temperatură în cristalele de gheață de apă suprarăcite încep să apară. Mercurul se ridică repede și se oprește. În termen de treizeci de secunde uitam poziția meniscului și poziția meniscului numărătoarea inversă fixă temperatura produsului.
4. După îndepărtarea cilindrului din amestecul de răcire este încălzită manual. În acest caz, cristalele de gheață se topesc. Dezghețarea cu agitare continuă până când mercurul se ridică la nivelul genunchiului capilar superior.
5. Puneți vasul din nou la răcire și amestecul a fost determinată lectură termometru corespunzătoare temperaturii de congelare. Totală a produs trei astfel de definiții. Rezultatul ar trebui să fie media aritmetică a trei determinări.
Experiența № 2. Determinarea punctului de congelare al soluției
1. Într-un pahar uscat de 150 ml se prelevează o probă de aproximativ 3,5 g de glucoză, până la 0,01 g pipeta 100 ml de apă, se agită până la dizolvarea completă a glucozei baton.
2. Cilindrul a fost clătită cu o mică porțiune din soluție. Apoi se toarnă în 70 ml de soluție.
3. Se efectuează temperatura de congelare, așa cum este descris mai sus. Rezultatul trebuie să fie media aritmetică a trei determinări paralele.
4. Se repetă determinarea prin prelevarea probei de 2,5 g glucoză și 1,5 g
Măsurat prin masa moleculară calculată a glucozei.
1. Mortar (definiție, metode de expresie concentrație a soluției). Care este solventul, solut?
2. Care este soluția „ideală“?
3. Ceea ce se numește abur saturat?
4. Legea Raul. Abaterea de la legea lui Raoult.
5. Consecințele legii lui Raoult.
6. Care este punctul de fierbere, punctul de îngheț?
7. Explicați cauzele fenomenului și ebullioscopy cryoscopic. Când răspundeți utiliza orez. 1-2.
8. Extrageți formula de calcul Tzam bp și pentru soluții diluate de non-electroliti si electroliti.
9. ebullioskopichesky cryoscopic și metode de determinare a substanțelor cu greutate moleculară.
10. cryoscopic și constantă ebullioskopicheskaya. Cum pot fi calculate și cum să se determine experimental?
11. Cum de a alege un solvent pentru cryoscopic și ebullioskopii?
12. Ce este osmoză?
ecuația Hoff 13. van't pentru calcularea soluțiilor presiunii osmotice de non-electroliti.
Proprietățile 14. coligative soluțiilor electrolitice.
15. Coeficientul izotonică. Cum pot determina cantitatea de factor izotonice, ceea ce depinde?
16. Conceptul de soluții izotonice, hipertonice și hipotonice.
17. Se calculează punctul de fierbere și punctul de congelare al unei soluții apoase de fructoză cu o fracție de masă de 4%.
18. Calculați nonelectrolyte masa molară, în cazul în care este cunoscut faptul că scăderea temperaturii de congelare a unei soluții care conține 5 g din acest material în 500 g de apă, egal cu 0,102 K.
19. Care ar trebui să fie greutatea de zaharoză dizolvată în 250 g de apă pentru a obține o soluție, la fierbere, la 100,2 ° C? La ce temperatură să înghețe soluția?
20. Greutatea calculează de uree, care poate fi dizolvat în apă într-un balon de capacitate de 200 ml pentru a obține o soluție, soluție izotonică ce conține 4,28 g de greutate zaharoză în soluție de 100 ml.
21. Presiunea osmotică a concentratului de cafea la 10 ° C este de 2,37 MPa. Se calculează osmolaritatea soluției.
22. descriu comportamentul electroliților la 310 K într-o soluție de glucoză cu o fracție de masă de 2% (g / ml densitate 1,006 soluție).
23. Calculați presiunea osmotică la soluție apoasă de manitol 310 K de 10%, cu o densitate de 1,04 g / ml, care este utilizat pentru scăderea presiunii intracraniene. Cum este această soluție (hipo-, hiper- sau izotonice), în ceea ce privește soluțiile a-d având următoarele valori ale osmolarității: a) 780 kPa (sânge, limita superioară); b) 730 kPa (sânge, limita inferioară); c) 258 kPa; g) a fost 3091 kPa; e) 1,472 kPa?