curs organice
Se Prelegeri 2. Substanțe organice. proteine
La compusul rganicheskie sunt în medie de masă 20-30% din celulele vii ale unui organism. Acestea includ polimeri biologici - proteine, acizi nucleici și polizaharide, precum și grăsimi și un număr de substanțe organice cu greutate moleculară mică - aminoacizi, zaharuri simple, nucleotide etc. Polimeri - moleculă ramificată sau liniară complex, hidroliză se descompun la monomeri. Dacă polimerul este compus dintr-un fel de monomeri, polimerul este numit un homopolimer. Dacă compoziția moleculei de polimer conține diferite monomeri - este un heteropolimer. În cazul în care un grup de diferite monomeri în molecula de polimer se repetă (A, B, C, A, B, C, A, B, C) - este un heteropolimer regulat. în cazul în care nu există nici o repetare a unui anumit grup de monomeri - hetero neregulate.
Celulele de substanțe organice din numărul și valoarea primului loc sunt proteine. Proteine. sau proteine (din protos greacă -. În primul rând, principalele) - macromolecular heteropolimeri, substanțe organice și se descompun în aminoacizi la hidroliză. Valoarea de proteine este atât de mare încât informațiile cu privire la proteinele incluse în cele două definiție cele mai populare de viață: „Viața este modul de existență a organismelor de proteine, esențiale a căror element este schimbul constant de substanțe cu natura exterioară înconjurătoare, precum și cu încetarea acestui metabolism încetează și viața care conduce proteină degradabilă „(Engels). „Organisme existente în lumea vie, sunt deschise, auto-reglare și sistem de auto-reproducere, construite din biopolimeri - proteine și acizi nucleici“ (M.V.Volkenshteyn).
Structura simplă a proteinelor (constând numai din aminoacizi) includ carbon, hidrogen, azot, oxigen și sulf. Proteinele Partea (proteine complexe) formează complecși cu alte molecule care conțin fosfor, fier, zinc și cupru - sunt proteine complexe care conțin aminoacizi, în plus, de asemenea, neproteinacei - grupare prostetică. Acesta poate fi reprezentat de ioni metalici (metaloproteinelor - hemoglobină), glucide (glicoproteine), lipide (lipoproteine), acizi nucleici (nucleoproteine).
Proteinele sunt heteropolimeri neregulate. care monomerii sunt α-aminoacizi. Celule si tesuturi a fost gasit peste 170 de aminoacizi diferiți, dar numai 20-aminoacizi incluși în proteină. În funcție de faptul dacă aminoacidul sintetizat în organism, se disting: aminoacizi esențiali - zece aminoacizi sintetizat în organism și aminoacizi esențiali - aminoacizi care nu sunt sintetizați în organism. aminoacizi esențiali trebuie să fie ingerate cu alimente.
În funcție de compoziția de aminoacizi a proteinelor sunt complete. în cazul în care conțin întregul set de aminoacizi esențiali și inferior. dacă oricare dintre aminoacizii esențiali în compoziția lor, nu.
Formula generală a aminoacizilor este prezentat în Fig. Toate-aminoacizi la atomul de carbon α includ atomul de hidrogen, o grupare carboxil (-COOH) și amino (-NH2). Restul moleculei este un radical.
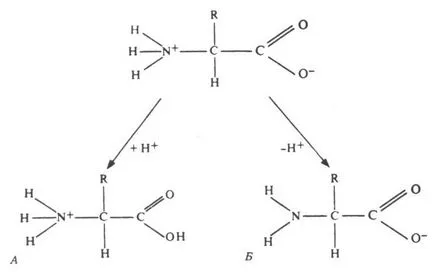
Fig. 255. proprietăți amfoteri ale aminoacizilor la diferite pH.
minogruppa se atașează cu ușurință de ioni de hidrogen, adică Acesta arată proprietățile de bază. Gruparea carboxil este ușor dă ioni de hidrogen - acidul manifestă proprietăți. Aminoacizii sunt compuși amfoterici, deoarece acestea sunt în soluție poate acționa atât ca acizi și baze. În soluții apoase, aminoacizi există în diferite forme ionice. Acest lucru depinde de pH-ul și pe ce aminoacid: neutru, acid sau bazic.
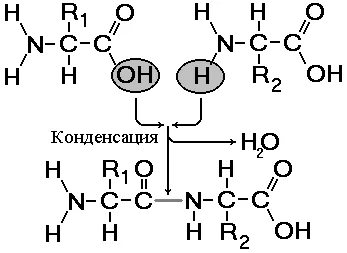
Fig. 256. Formarea dipeptidei.
În funcție de numărul de grupări amino și grupe carboxil în compoziția de aminoacizi, distinge aminoacizi neutri având o grupare carboxil și o grupare amino de aminoacizi bazici având un radical alți aminoacizi și aminoacizi având mai multe grupări carboxil în radicalul.
Peptidele - substanțe organice, care constau dintr-un număr mic de resturi de aminoacizi unite prin legături peptidice. Formarea peptidelor rezultate din reacția de condensare a aminoacizilor (Fig.).
În reacția grupării amino a unui aminoacid cu o grupare carboxil alta, ele nu covalentă legătură azot-carbon, care se numește o peptidă. În funcție de numărul de resturi de aminoacizi care cuprinde peptida distinge dipeptide, tripeptide tetrapeptide etc. Formarea legăturii peptidice poate fi repetată de mai multe ori. Aceasta conduce la formarea de polipeptide. Dacă polipeptida constă dintr-un număr mare de resturi de aminoacizi, este deja numite proteine. La un capăt al moleculei este gruparea amino liberă (numită N-end), iar celălalt - gruparea carboxil liberă (numit C-terminal).
Structura moleculei de proteină.
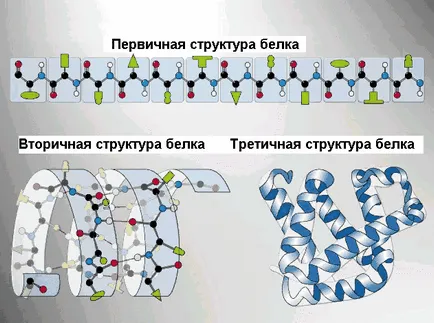
Executarea anumitor proteine funcții specifice care depind de configurația spațială a moleculelor în plus, colivia energetic nefavorabil menține proteine în formă extinsă, ca un lanț, astfel încât lanțurile polipeptidice expuse pozare definit structura dobândirea tridimensională sau conformație. 4 niveluri de organizare spațială a proteinelor.
Structura primară a proteinei - o secvență de resturi de aminoacid localizarea în lanțul polipeptidic al componentei moleculei de proteină. Comunicarea dintre aminoacizii - Peptide.
moleculă de proteină de fuziune constă din resturile de acid numai 10 aminoacizi, numărul teoretic posibile molecule proteice diferite opțiuni în procedura de intercalare aminoacizi - 20 10. proteine derivate din organisme vii, sunt formate de sute și uneori mii de resturi de aminoacizi.
La om, ordinea observată a zece mii de proteine diferite, care diferă unul de altul și de proteinele altor organisme.
Este structura primară a moleculei de proteină determină proprietățile proteinei și configurația spațială. Înlocuirea doar un aminoacid cu altul în lanțul polipeptidic conduce la o schimbare a proprietăților și funcția proteinei. De exemplu, înlocuirea în ß-subunitate a hemoglobinei sasea amino acid glutamic la valină determină molecula de hemoglobină ca întreg nu își poate îndeplini funcția de bază - transportul oxigenului (în astfel de cazuri, se dezvolta boala la om - siclemie).
Prima proteină, a cărei secvență de aminoacizi a fost identificat, a devenit insulina. Studiile au fost efectuate în F.Sengerom Universitatea din Cambridge 1944-1954. Sa constatat că molecula de insulină este formată din două lanțuri de polipeptide (21 și 30 de resturi de aminoacizi), a avut loc unul lângă altul prin punți disulfidice. Pentru munca grea F.Senger a fost distins cu Premiul Nobel.
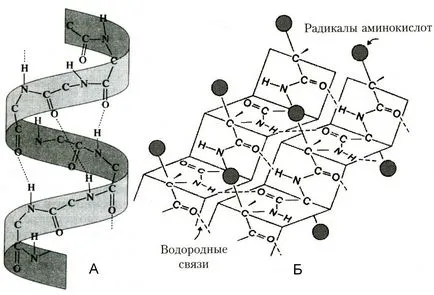
Fig. Protein structura secundară
Structura toricity - o pliere ordonată a lanțului polipeptidic în α-helix (o formă întinsă arc) și β-struktra (strat pliat). Elicea α- NH-grupa a restului de aminoacid reacționează cu grupul CO al patrulea rest din ea. Aproape toate „CO“ și „NH-grupul“ implicat în formarea de legături de hidrogen. Ele sunt mai slabe decât peptida, dar a repetat de multe ori, această configurație conferă stabilitate și rigiditate. Proteinele există la nivelul structurii secundare: fibroină (matase, web), keratină (păr, unghii), colagen (tendon).
strat împăturit (sinonim β-struktra) se formează dacă segmentele catene polipeptidice dispuse în paralel sau antiparalel unul cu altul într-un singur strat. Aceasta formează o figură care seamănă cu o frunză, burduf pliate.
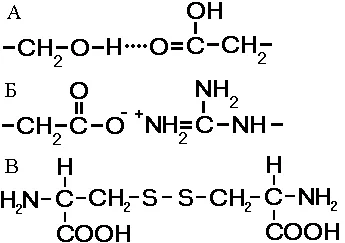
Fig. Comunicare, stabilizarea structurii terțiare:
A - hidrogen, B - Ion, The - disulfurii.
Structura retichnaya - stabilirea lanțurilor polipeptidice în globulele. apare ca urmare a legăturilor chimice (hidrogen, ionic, disulfidice) și stabilirea interacțiunilor hidrofobe dintre radicalii de resturi de aminoacizi. Rolul principal în formarea structurilor terțiare joacă un interacțiuni hidrofil-hidrofob. În soluție apoasă radicalii hidrofobi tind să se ascundă de apa globulelor sunt grupate în interior, în timp ce radicalii hidrofili prin hidratarea (reacția cu dipolii apa) tind să fie pe suprafața moleculei.
Unele structuri terțiare proteină stabilizate prin disulfidice legături covalente apărute între cei doi atomi de sulf din resturile de cisteină. La nivelul structurii terțiare, există enzime, anticorpi, unii hormoni. Forma moleculei distinge proteine globulare și fibroase. În cazul în care proteinele fibrilare funcționează în principal sprijinirea funcției, proteinele globulare sunt solubile și de a efectua o varietate de funcții în citoplasmă sau în mediul intern al unui organism.
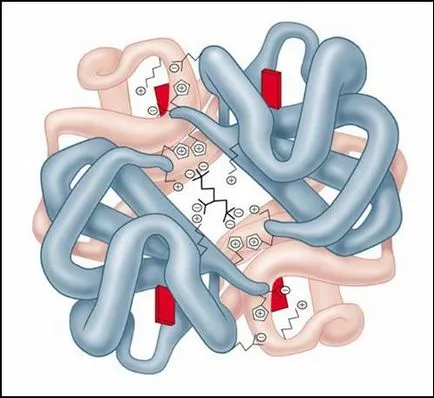
Fig. molecula de hemoglobina
Structura etvertichnaya este tipic pentru proteine complexe, care moleculele sunt formate din două sau mai multe globulelor. Subunitățile sunt deținute exclusiv în moleculă prin legături necovalente, în principal hidrogen și hidrofobe.
Proteina cea mai studiată având structura cuaternară este hemoglobină. Acesta este format din două subunități (141 resturi de aminoacizi) și două subunități (146 resturi de aminoacizi) .Cu fiecare subunitate legată moleculă hem care cuprinde fier.
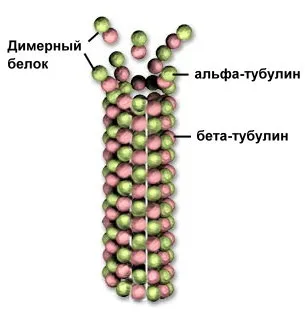
Fig. Microtubulii de la tubulina
Proteinele picioare cu structură cuaternară ocupă o poziție intermediară între moleculele și organitelor celulare - de exemplu, microtubule citoscheletului proteină compusă din tubulinei. constând din două subunități. Tubul este extins la aderarea dimerului până la capăt.
Dacă, din orice motiv, conformația spațială a proteinei se abate de la proteina normală nu poate îndeplini funcțiile sale
Compoziția de aminoacizi, structura moleculei proteice determină proprietățile sale. Proteinele se combină proprietăți bazice și acide definite de radicali amino, cele mai acide aminoacizi dintr-o proteină, cu atât mai pronunțată proprietățile sale acide. Capacitatea de a atașa și livra + H determina proprietățile de tamponare a proteinelor, una dintre cele mai puternice tampoanele - hemoglobină în celulele roșii din sânge, sprijinind pH-ul sanguin la un nivel constant.
Sunt proteine solubile (fibrinogen), nu sunt insolubile. realizarea funcțiilor mecanice (fibroină, keratina, colagen).
Orice proteine active de vedere chimic (enzime), este chimic inactiv. rezistente la diferite condiții de mediu și extrem de instabilă.
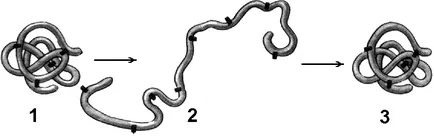
Fig. Denaturarea și renaturarea proteinei:
1 - structura terțiară a moleculei de proteină; 2 - proteină denaturată; 3 - recuperarea structurii terțiare în timpul renaturare.
Factori de dilatare externi (căldură, radiații ultraviolete, metale grele și sărurile lor, modificări ale pH-ului, radiații, deshidratare) poate provoca o încălcare a organizării structurale a moleculelor proteice. Pierderea conformația tridimensională a proteinei inerente în molecula fără a distruge nazyvayutdenaturatsiey structurii primare.
Motivul este decuplarea Denaturarea, o anumită stabilizare a structurii proteinei. Inițial rupt cea mai slabă conexiune, în timp ce înăsprirea condițiilor și mai puternice. De aceea cuaternară a pierdut mai întâi, apoi o structură secundară și terțiară. Modificări în configurația spațială conduce la o modificare a proprietăților de proteine și, în consecință, face imposibilă executarea funcției sale de proteine inerente biologice.
În cazul în care Denaturarea nu este însoțită de distrugerea structurii primare, poate fi reversibilă. în acest caz, caracteristica de auto-vindecare a conformației proteinelor. O astfel de denaturare expuse, de exemplu, proteine receptor de membrană. Procesul de recuperare după denaturare a structurii proteinei numite renaturare. Dacă restaurarea configurației spațiale a proteinei nu este posibilă, Denaturarea este numit ireversibil. Distrugerea structurii proteinei primare numita degradare.
Datorită complexității, diversității de forme și compoziții, proteinele joaca un rol important in celulele corpului, și viața în general. diverse funcții lor.
Omenirea a intrat într-o nouă eră a existenței sale, atunci când puterea potențială a substanței chimice, biologice și fizice înseamnă că creează un impact asupra habitatului devine comparabil cu forțele naturii.
Biochimie funcțională (legătură între structura substanțelor și a proceselor lor de modificare, pe de o parte, și funcția de organite, celule, țesuturi și organe care conțin aceste substanțe.
Solul este format pe suprafața pământului în acea porțiune din biosferă unde interlock și întrepătrund unul pe altul litosfera, hidrosfera și atmosfera, și în care densitatea planetei materie vie deosebit de mare.
Prima referință sistematic scurt orientările științifice privind umane eco-ogy, care include circa 2 mii. Termeni și definiții în întregul volum de probleme legate de caracteristicile ecosistemelor „om cu natura-da“, „om-producție.“
Prima referință sistematic scurt orientările științifice privind umane eco-ogy, care include circa 2 mii. Termeni și definiții în întregul volum de probleme legate de caracteristicile ecosistemelor „om cu natura-da“, „om-producție.“