Curs 12 Prima lege a termodinamicii
Aplicarea primei legi a termodinamicii
12.1. Izoprotsessy. Lucrul la izoprotsessah
Printre procesele de echilibru care au loc în sistemele termodinamice, izoprotsessy izolate - procese de echilibru, în care unul dintre principalii parametri este menținut constant.
1. Procesul de izocoră (
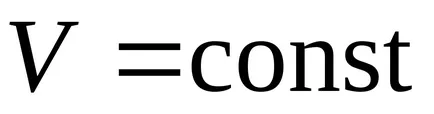
1-3 - răcire izocoră; 1-2 - încălzire izocoră. la
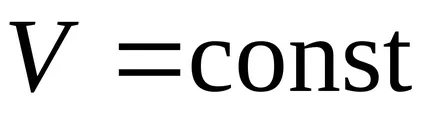
.
Din prima lege a termodinamicii, astfel încât prima lege a termodinamicii în cadrul procesului de izocoră:
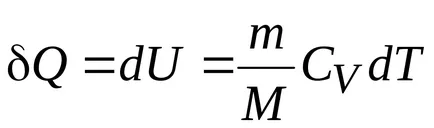
Căldura transmisă la gaz în procesul izocoră, există o schimbare (creștere) energia internă a sistemului.
2. Procesul de izobară (
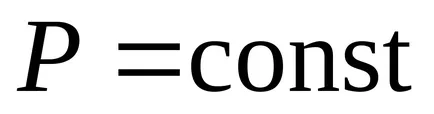
Din prima lege a termodinamicii:
,
în consecință, prima lege a termodinamicii în cadrul procesului de izobară:
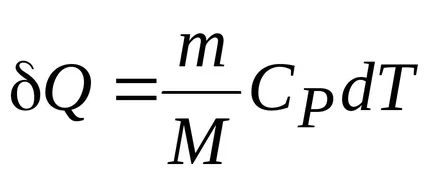
Activitatea în cadrul procesului de izobară:
.
dacă
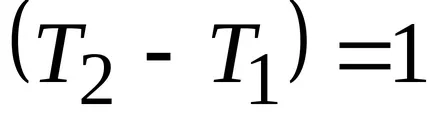
3. Procesul de izoterme (
Prima lege a termodinamicii :. la
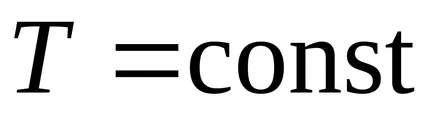
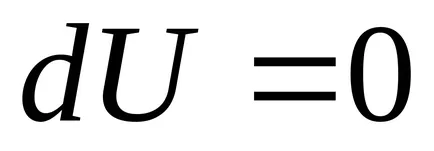
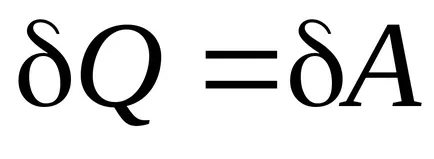
Activitatea de expansiune izoterma:
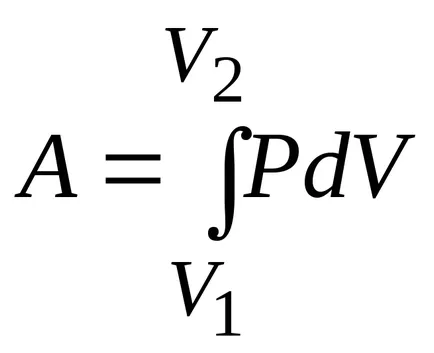
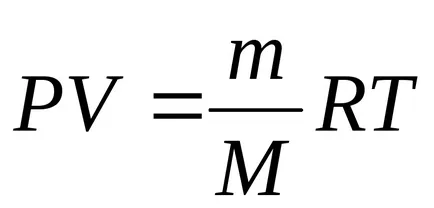
,
Prin urmare, lucrează într-un proces izoterm:
.
Prima lege a termodinamicii pentru proces izoterme:
.
Concluzie. toată cantitatea de căldură transmisă la gazele naturale consumate pentru a le face să funcționeze împotriva forțelor externe.
La timpul gaz temperatura este scăzută, la gaz în procesul izoterm este necesară pentru a furniza cantitatea de căldură echivalentă expansiunii externe.
12.2. proces adiabatic
Izoprotsessam K poate fi atribuita procesului adiabatic - un proces în care nu există nici un schimb de căldură cu mediul înconjurător.
Exemplu. de compresie a aerului și de tensiune în val de sunet, funcționarea motorului cu ardere internă.
Prima lege a termodinamicii. sistemul funcționează în detrimentul energiei interne a sistemului.
expresie
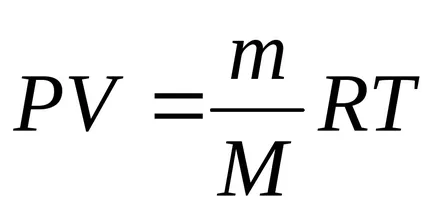
Categorii (12.2) la (12,1):
,
;
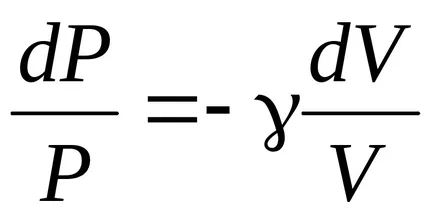
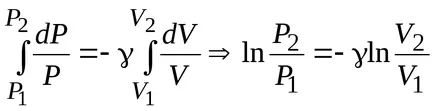
.
ecuația lui Poisson
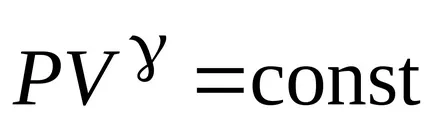
Ecuația lui Mendeleev-Clapeyron și exprimă presiunea acestuia P., de unde ecuația Poisson în coordonatele (TA V).
Express de volum ecuației Mendeleev-Clapeyron :, Poisson otkudauravnenie în coordonate (T P).
Ecuația procesului adiabatic:
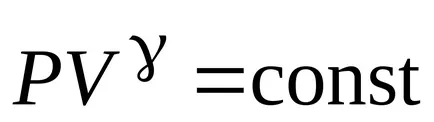
;
,
unde
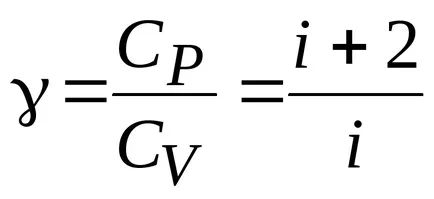
Grafic adiabatic - relații grafic care arată între parametrii statului gaz ideal la
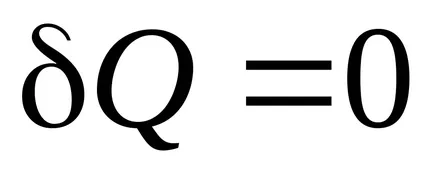
adiabat
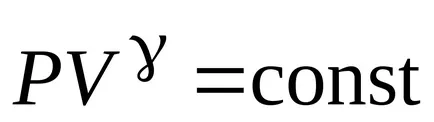
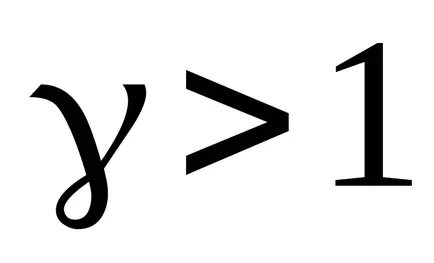
gaze de lucru într-un proces adiabatic.
.
Lucrul cu un proces adiabatic:
Concluzie: în cazul în care gazul se extinde de la adiabatic



;
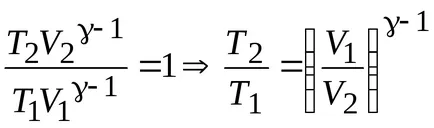
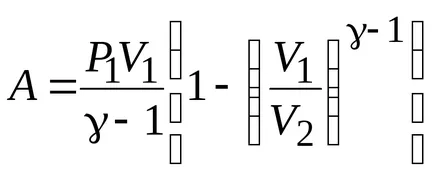
De lucru în timpul procesului de expansiune adiabatică mai mică decât pentru o expansiune izotermă. Acest lucru se datorează faptului că, atunci când expansiunea adiabatică răcirea gazului în timp ce sub temperatura de expansiune izotermă este menținută constantă datorită fluxului din exteriorul cantitatea echivalentă de căldură.
Concluzie: considerat izocoră, izobară, izoterme și procesele adiabatice au o trăsătură comună - au loc la o capacitate de căldură constantă.
Un proces în care căldura specifică este constantă se numește politropic. ecuația politropic.
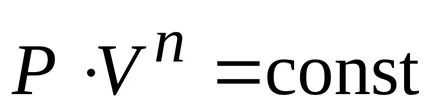
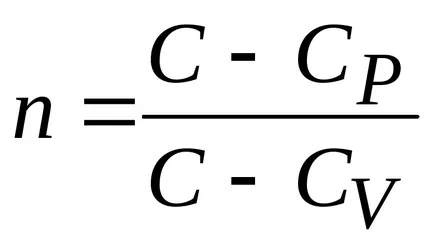
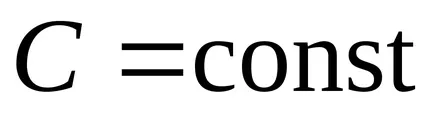
Concluzie. toate procesele de mai sus sunt cazuri speciale ale procesului politropice.
Coordonatele R. V politrope - Graficul parametrilor de stat in
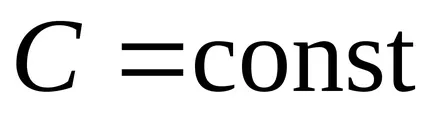
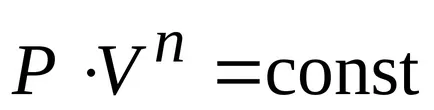
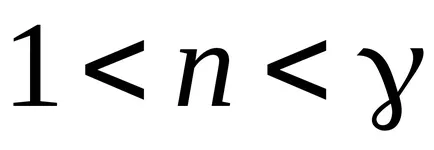
Ce este izoprotsessy? Izoprotsessy Ce știi?
Formulele pentru calcularea muncii la diferite izoprotsessah și arată modul în care axele lor în graficele p, V este reprezentat, această lucrare.
Draw (pe planul P, V) și izoterma adiabatic. Explicați de ce adiabatic cu creșterea V picături mai abruptă decât izotermei?
Deriva ecuatia Poisson. Care este indicele adiabatic?
Prin gaz sub expansiune adiabatică funcționează împotriva forțelor externe? Ce se întâmplă cu temperatura de expansiune adiabatic un gaz ideal?
Ceea ce se numește un proces politropic?
Se încălzește la un proces izoterma este
Greutate 16g oxigen este la o presiune de 300 kPa și o temperatură de 27 ° C. După încălzire la presiune constantă a volumului de gaz a luat 10 litri. Găsiți cantitatea de gaz produsă de căldură, variația energiei interne a gazului și activitatea desfășurată în gazul de expansiune. [6142.5 J; 4387.5 J; 1755 J].
de gaz diatomic a raportat numărul de 2,093 kJ de căldură. Gaz extinde isobarically. Găsiți o expansiune a gazelor de locuri de muncă. [598 J].
masă de azot m = 56 g, situată în condiții normale, este extins adiabatic, volumul de gaz este dublat. Definiți: 1) modificarea energiei interne a gazului AU; 2) O lucrare de expansiune a gazelor. [= DU - kJ 2,75; A = 2,75 kJ]