Curentul electric in electroliti este fizica
Electroliți numit mediu conductor, în care fluxul de curent electric este însoțit de transferul de material. Cei liberi purtătorilor de sarcină în electroliți sunt ioni încărcați pozitiv și negativ. Prin electrolitii includ mulți compuși ai metalelor în stare topită, precum și unele solide. Cu toate acestea, principalii reprezentanți ai electroliti sunt larg utilizate în domeniu sunt soluții apoase de acizi anorganici, săruri și baze.
Trecerea curentului electric prin electrolit însoțită de eliberarea de substanțe pe electrozi. Acest fenomen se numește electroliza.
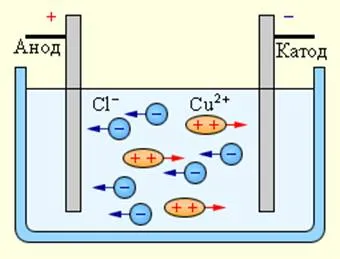
Curentul electric în electrolit se deplasează ionii de ambele semne în direcții opuse. ioni pozitivi trece la electrodul negativ (catod) și ioni negativi - un electrod pozitiv (anod). ionii ambelor semne apar în soluții apoase de săruri, acizi și baze, ca rezultat al scindării porțiunii molecule neutre. Acest fenomen se numește disociere electrolitica. De exemplu, clorura de cupru, CuCI2 în soluție apoasă disociază în ioni și clor cupru:
La conectarea electrozilor la ionii sursa de curent sub câmpul electric începe mișcare comandate: ionii pozitivi de cupru muta spre catod și ionii de clor încărcați negativ - la anod (Fig 1.15.1).
La atingerea ionii catodice și cupru sunt neutralizate prin exces electronii catodului și transformate în atomi neutri depuși pe catod. ionii de clor care ajung la anod, un electron este dat. După aceea, atomii de clor neutri sunt unite pairwise pentru a forma molecule de clor Cl2. Clorul eliberat la anod sub formă de bule.
In multe cazuri, electroliza însoțite de reacții secundare ale produșilor de descompunere a evoluat la electrozi, cu materialul electrozilor sau a solvenților. Un exemplu este electroliza unei soluții apoase de sulfat de cupru CuSO4 (sulfat de cupru), în cazul în care electrozii sunt coborâte în electrolit, realizat din cupru.
Disocierea molecule de sulfat de cupru are loc conform schemei
atomi de cupru neutre sunt depuse sub forma unui precipitat solid pe catod. Acest lucru face posibilă obținerea cuprului chimic pură. Ion anod dă doi electroni și se transformă într-un SO4 radical neutru intră într-o reacție secundară cu un anod de cupru:
Rezultată sulfatul de cupru molecula merge în soluție.
Astfel, prin trecerea curentului electric printr-o soluție apoasă de sulfat de cupru se dizolvă anod de cupru și depunerea cuprului pe catod. Concentrația soluției de sulfat de cupru nu este schimbat.
m substanță în masă a evoluat la electrodul este direct proporțională cu Q. încărcare a trecut prin electrolit:
Valoarea lui k se numește echivalentul electrochimic.
Mass evoluat pe materialul electrodului egal cu masa ionilor vin la electrodul:
Aici, m0 și q0 - masa și încărcare a ionului, - numărul de ioni care vin la electrod la trecerea prin electrolitul rechizitoriul Q. Astfel, electrochimică echivalentă k este raportul dintre m0 masa ion a substanței q0 sale de încărcare.
Deoarece sarcina ionului este produsul valența substanței asupra n sarcina electrica elementara e (q0 = ne), expresia pentru echivalentul electrochimic al k poate fi scrisă ca
Faraday constantă este numeric egală cu încărcătura, care trebuie să treacă prin electrolit pentru a separa la electrodul de un mol de substanță monovalent.
legea lui Faraday de electroliză devine:
Fenomenul electroliză este utilizat pe scară largă în producția industrială modernă.