
Este posibil să „reînvie“ bateria epuizată. Unii meșteșugari știu cum se face: prin bateria uscată epuizat este trecut curent impulsuri speciale. Această operațiune, uneori, de a face de mai multe ori. Cu toate acestea, ea restabilește pe scurt elementul. Stai, stai! Orice ar fi fost, se pare că o celulă galvanică - aceeași baterie! Încărcarea șocul electric, restabilirea, vom acumula energie în el, care poate cheltui apoi. Este adevărat? Se pare că sau nu. În primul rând, nu fiecare element poate fi reîncărcat. Este imposibil de a face acest lucru, de exemplu, cu un element în care există două electrolit lichid. Un exemplu este Daniel elementul, în care două lichide diferite separate printr-o cupă poroasă. Treptat curgând prin sticla, electrolitii se amestecă, reacționează unul cu celălalt și să emită curent. Acest element, în cazul în care acesta este deja împlinit termenul său, nu și-a revenit. Alte elemente cu electrozi solide de reîncărcare, stoca energie în principiu, dar procesul de acumulare, astfel nerentabilă și ineficientă, că mulți consideră că este inutil. Acumulând doar o parte neglijabilă din energia electrică furnizată elementului și elementul în sine, după mai multe astfel distruse încărcări. Pentru a deveni o unitate de bun, o celulă galvanică ar trebui să fie suficient de bun pentru a efectua procesul de încărcare. Acest lucru în cele din urmă a reușit, în mijlocul secolului al XIX-lea. În 1859, om de știință și inginer francez Gaston Plante a petrecut o experiență interesantă, exterior foarte asemănătoare cu experiența Volta. Ca Volta, construit Plante celule electrochimice, cu toate acestea, așa cum a luat două plăci de electrozi de plumb, în condiții normale, acoperite cu o peliculă de oxid de plumb. Electrolitul a fost același - acid sulfuric diluat. Plante conectat la electrozii din sursa de curent constant și de ceva timp a trecut un curent prin elementul său, la fel ca atunci când reîncărcare celulele uscate. Apoi a oprit curentul și conectat la electrozii unui galvanometru. Aparatul a arătat că elementul PLANTE a devenit el însuși a genera curent electric, și, astfel, individualizata aproape toată energia cheltuită pentru exerciții. poate fi repetată de încărcare un număr mare de ori - întotdeauna un element lucrat bine, nu a distrus, cum ar fi bateriile uscate. Această celulă electrochimică a fost numit element al doilea tip, sau o baterie. Pe măsură ce energia se acumulează în bateria Plante? Când un curent este trecut prin electrolit de acid sulfuric la o placă de plumb conectat la polul negativ al sursei de alimentare - catod, hidrogenul este eliberat, ceea ce reface oxidul de plumb în plumb pur. Electrodul conectat la polul pozitiv - anod, oxigenul este eliberat, care oxidează oxidul de plumb la peroxid. Bateria este încărcată când catod va conduce în întregime pură, iar anod - peroxid de plumb. Apoi va cea mai mare tensiune între electrozi. Conectarea conductorului placă de electrozi cu puterea cheltuielilor de consum, vom descărca bateria. Direcția actuală atunci când evacuarea opusul a ceea ce a fost în timpul încărcării. Pozitiv placa încărcată se va recupera hidrogen și negativ - oxidabile cu oxigen. După ce plăcile vor fi la fel, bateria se oprește curentul dătător. Este necesar să se repete exercițiile. Este clar că energia din baterie este stocată sub forma unei substanțe corporale - plumb, fier cu eliberarea de energie în peroxid de plumb. Chiar procesul de acumulare de energie și de eliberare se întâmplă aici în mod diferit decât în baterii pur electrice - condensatori. Prin urmare, o astfel de baterie se numește electrochimica.
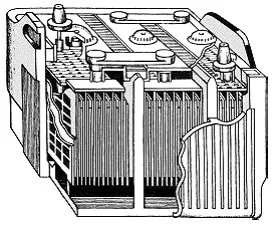
Fig. 1 Car baterie plumb-acid
In modele de baterii cu plumb acid auto (Fig. 1), cât mai mulți cercetători au încercat să crească suprafața electrodului posibil, fără a compromite rezistența lor. După toate din suprafața depinde de puterea bateriei. Acum plăcile de baterii sunt realizate sub forma unor grile de plumb acoperite cu peroxid de plumb (electrodul pozitiv) și un burete de plumb (electrodul negativ). Electrolitul este o soluție apoasă de acid sulfuric de 25-35%. baterie de mașină încărcată are o tensiune (mai precis - forța electromotoare) la bornele din 2 - 2.2 V. Când descărcare această tensiune scade, iar atunci când ajunge la 1,8 V, de descărcare este de obicei oprită, în caz contrar grila poate duce prea diluata în timpul reacției, și plăci, pierde puterea, se năruie. Vrei să știi ce se va întâmpla cu bateria, dacă încercați să obțineți cel puțin un curent de mare putere pe termen scurt de la ea? Apoi rotiți demarorul, alimentat de o baterie, dar fără alimentarea cu combustibil a motorului. Motorul, desigur, nu va porni, și după 15-20 de secunde, demarorul începe să vânt în jos. Ceva timp mai târziu, el sa oprit. Se va completa impresia că bateria este mort, și mai mult de ea pentru a „stoarce“ nu poate fi nimic. Dar apoi, după câteva minute, demarorul va lucra din nou! În cazul în care sunt forțele în baterie? El nu poate, ca o ființă vie, să se relaxeze? De fapt, comportamentul bateriei și organismul viu sunt izbitor de asemănătoare. Atunci când oboseala musculară din forța lor de muncă grea este redus drastic, și este nevoie de timp, astfel încât acesta și-a revenit. Omul va face mult mai mult dacă va funcționa în mod egal, cu o putere de încărcare constantă, dar mici. De exemplu, dacă încercați să executați până la etajul 20 al casei, cu este puțin probabil să reușească o singură dată, aceasta trebuie să se odihnească. Da, și obosit după acest lucru se va simți considerabil. Și dacă te duci în liniște, cele 20 de etaje pot fi depășite fără prea multă oboseală. Și în acumulator: atunci când sunt încorporate într-un acid sulfuric de mare capacitate, care a fost în porii plăcilor consumate rapid în reacție este transformată în apă și izolarea opritoarele curente. Numai după ceva timp, atunci când acidul sulfuric este treptat re-umple porii, se pot descărca din nou bateria. Prin urmare, încărcat și descărcat de baterii (acest lucru este valabil pentru aproape toate tipurile de baterii electrochimice), de obicei, cu o suficient de mici curenți de sarcină și mici pentru o lungă perioadă de timp - de mai multe ore. Aici se află unul dintre principalele dezavantaje ale bateriilor electrochimice - puterea redusă la 1 kg de greutate a bateriei, așa-numita densitate de putere sau densitate de putere. baterii plumb-acid sunt destul de economic, dar ele sunt capriciosi, adesea perisabile, de scurtă durată. In afara de plumb - metale relativ rare și scumpe și de acid este periculos de manevrat. Desigur, că oamenii de știință au început să caute noi materiale și noi principii de viață a bateriei. Deci, a fost al doilea tip principal de baterii electrochimice - Baterii alcaline. Ceea ce le face este strâns legată de numele celebrului om de știință american și inventator Thomas Edison (1847-1931).



