chimie cărbune Formula
Cărbune - una modificări alotropice ale elementului chimic carbon.
Structura atomilor de carbon este prezentată în Fig. 1. În plus față de cărbune, carbon pot exista sub forma unei substanțe simplu de diamant sau grafit aparținând sistemelor hexagonale și cubice, cocs, funingine, carbyne polikumulena graphene, fullerene, nanotuburi, nanofibre, etc. astralene
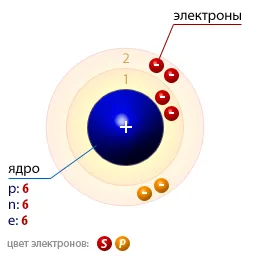
Fig. 1. Structura atomilor de carbon.
Formula chimică a cărbunelui
Formula chimică a cărbunelui - C. Se arată că molecula substanței este unul dintre atom de carbon (Ar = 12 uam). Conform formulei chimice poate fi calculată cu greutate moleculară de cărbune:
M (C) = Mr (C) x 1 = 12.0116 mol g / mol
Structură (grafic) Formula Cărbunele
Este mai descriptiv bloc (grafic) Formula cărbunelui. Ea arată modul în care atomii sunt conectate unul la celălalt în interiorul moleculei (Fig. 2).
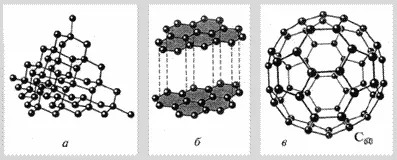
Fig. 2. Structura modificărilor de carbon alotropice: a) diamant; b - grafit; c) - fullerene.
formula E
formula E. care prezintă o distribuție a electronilor atomului de subnivele de energie este prezentată mai jos:
6 1s C 2s 2 2 2p 2
De asemenea, arată că carbonul se referă la elementele p-familie precum și numărul de electroni de valență - în funcție de nivelul de energie exterior este de 4 electroni (2s 2 2p 2).
Exemple de rezolvare a problemelor
fracție de masă de clor din clorură de fosfor este de 77,5%. Se determină cel mai simplu compus cu formula.
fracțiunea de masă a elementului X în compoziția moleculei HX calculată cu următoarea formulă:
ω (X) = n × Ar (X) / M (HX) x 100%
Noi calcula fracțiunea de masă a fosforului din compus:
ω (P) = 100% - ω (Cl) = 100% - 77,5% = 22,5%
Notăm numărul de moli de elemente ale conexiunilor pentru „x“ (fosfor) și „y“ (cloro). Apoi, raportul molar va fi după cum urmează (valorile maselor atomice relative luate din Mendeleev Tabelul periodic, rotunjită la numere întregi):
x: y = ω (P) / Ar (P). ω (Cl) / Ar (CI);
x: y = 22,5 / 31. 77,5 / 35,5;
x: y = 0,726. 2183 = 1. 3
Prin urmare, compusul cu fosfor formula cu clor va fi în forma PCI3. Această clorură de fosfor (III).
Se determină cel mai simplu compus cu formula potasiu la mangan și oxigen, dacă potasiu este fracțiunea de masă de 24,7%, 34,8% mangan.
fracțiunea de masă a elementului X în compoziția moleculei HX calculată cu următoarea formulă:
ω (X) = n × Ar (X) / M (HX) x 100%
Se calculează fracțiunea de masă a oxigenului în amestec:
ω (P) = 100% - ω (K) - ω (Mn) = 100% - 24,7% - 34,8% = 40,5%
Notăm numărul de moli de elemente ale conexiunilor pentru „x“ (potasiu) „y“ (mangan) și «z» (oxigen). Apoi, raportul molar va fi după cum urmează (valorile maselor atomice relative luate din Mendeleev Tabelul periodic, rotunjită la numere întregi):
x: y: z = ω (K) / Ar (K). ω (Mn) / Ar (Mn). ω (O) / Ar (O);
x: y: z = 24,7 / 39. 34,8 / 55. 40.5 / 16;
x: y: z = 0,63: 0,63: 2,53 = 1. 1: 4
De aceea formula de potasiu, mangan și oxigen va fi sub forma KMnO4. Acest permanganat de potasiu.