Catalog chimic acid carboxilic monobazic
carboxilic monobazic
Acizii carboxilici sunt compuși având o grupare carboxil -COOH. În funcție de numărul de grupe carboxil ale acizilor carboxilici sunt împărțite în monocarboxilici sau monobazic (o grupare -COOH), dicarboxilici sau dihidric (două grupe -COOH), etc. În funcție de structura unui radical hidrocarbonat, acizii carboxilici pot fi alifatici (de exemplu, CH3 COOH), aliciclic (acid C6 H3 ciclohexancarboxilic COOH) sau aromatic (acid benzoic C6 H5 COOH).
Nomenclatura.
Intervalul de substituție pe bază de acizi alifatici monocarboxilici sunt numele hidrocarburilor normale (cu catenă liniară) saturate. Prezența grupărilor carboxil reflectă acidul sufix -ovaya, de exemplu: CH3 COOH - etanoic, CH3-CH2-CH2-COOH, - acidul butanoic, CH3-CH (CH3) -COOH - acid 2-metilpropanoic. Denumirile sunt derivate din acizi aromatici, acizi benzoici, de exemplu:
Pentru unii acizi carboxilici bine stabilit nume triviale: acid formic - acid acetic HCOOH - CH3 COOH, acid butiric - CH3 CH2 CH2-COOH.
Izomeri.
izomerii structurali ai acizilor monocarboxilici datorită schelet ramificat carbon (butan și acid 2-metilpropanoic) și substituentul poziției reciproce, și o grupare carboxil în cicluri, de exemplu trei izomeri ai acidului benzoic.
Metodele de preparare.
1. În condiții naturale, unii acizi apar ca esteri de care pot fi preparați prin hidrolizarea:
R-CO-O-R „+ H 2 O <-> R-COOH + R'-OH
2. Oxidarea aldehide și alcooli primari. Ca oxidanții utilizate KMnO4. K2 Cr2 O7. HN03:
>>> >> Prepararea Oxidarea aldehidelor și alcooli primari „>
3. Oxidarea cetonelor conduce la formarea acizilor având mai puțini atomi de carbon pe moleculă decât cetonă inițială cm. Reacțiile secțiunii de oxidare carbonilului Compuși.
4. Pentru acidul benzoic poate fi utilizat oxidarea benzenului monosubstituiți Omologii soluție acidă de permanganat de potasiu:
5. Utilizarea unui reactiv Grignard în cadrul schemei:
>> Noțiuni de bază folosind Grignard „>
6. hidrocarburi cu halogen Hidroliza conținând trei atomi de halogen pe același atom de carbon:
Proprietăți fizice.
acid monocarboxilic inferior (C1 - C9) sunt un lichid incolor, alifatic superior și acizi aromatici - solide. First Omologii - formic, acetic și acidul propionic - posedă miros iritant ascuțit, miscibil cu apa în orice proporție. Deoarece porțiunea de hidrocarbură hidrofobă a moleculei scade solubilitatea apei. Temperatura acidă de fierbere mult peste punctele de fierbere ale alcoolilor și aldehidelor având același număr de atomi de carbon. Acest lucru se datorează faptului că acidul carboxilic în asociați în formă lichidă datorită legăturilor de hidrogen intermoleculare.
Proprietăți chimice.
1. acizi. Disociere Toți acizii carboxilici, acizi anorganici cum ar fi, au proprietăți acide, colorația turnesol roșie. Acest lucru se datorează disocierea acizilor:
RCOOH <-> RCOO - + H +
2. Formarea sărurilor. Acizii carboxilici sunt ușor vstu reacție Payuta cu baze, oxizi de bază și metale activi:
Săruri ale acizilor carboxilici puternic hidrolizată în soluție apoasă sub formă de săruri ale acizilor slabi. acizi minerali, cum ar fi acizii carboxilici dislocui mai puternici din sărurile lor:
CH3 COONa + HCI = CH3 COOH + NaCI
Acizii carboxilici sunt rezistente la acizi minerali concentrați. O excepție este acid formic, care, sub acțiunea concentrată H2S04 descompuse:
3. Formarea derivaților funcționali. Prin substituirea grupărilor hidroxil de diferite grupuri pot fi preparați derivați funcționali ai acizilor:
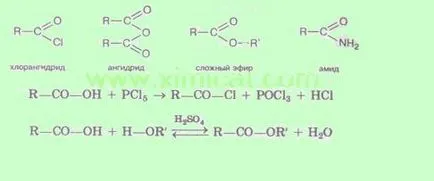
Caracteristica tuturor acestor compuși este că acestea sunt ușor hidrolizați pentru a forma acizi.
4. Sub acțiunea halogenilor în prezența acidului fosforos format acizi alfa halogenați:
5. Sub acțiunea agenților de reducere, cum ar fi LiAlH4. Acid sunt reduși la alcooli primari:
6. Acidul saturat cu o catenă de carbon liniară greu de oxida. Acid pentru a da un atom de carbon terțiar în oxidarea acizilor hidroxi:
In tot oxigenul acizii atmosferă sunt oxidați la CO2 și H2O
HCOOH Acid formic - lichid incolor, cu miros înțepător. Acesta se obține prin încălzirea oxidului de carbon (II) cu hidroxid de sodiu sub formă de pulbere:
NaOH + CO --- 200 0 C, P ---> HCOONa --- H2 SO4 ---> HCOOH
Acid formic are un număr de caracteristici:
a) se descompune sub acțiunea unor agenți de deshidratare pentru a forma CO;
b) este o reacție de reducere și dă „oglindă de argint“:
În plus, acidul formic este oxidat de clor:
Acid acetic CH3COOH este larg distribuit în natură, format în fermentație, putrefacție, vin skisanii, lapte, precum și prin oxidarea multor substanțe organice. Acidul acetic anhidru are un punct de topire + 16,6 ° C, cristalele sunt transparente ca gheața, de aceea este numit acid acetic glacial. In industrie, acidul acetic este produs prin oxidarea catalitică a butanului cu oxigenul din aer la 200 ° C:
Acidul acetic este miscibil în toate privințele cu apă, alcool, eter, benzen, este rezistent la oxidanți. Printre acizii grași ocupă un loc special acizi grași superiori - palmitic CH3 - (CH2) 14 COOH stearic și CH3 - (CH2) 16-COOH. Un număr mare de acizi grași superiori obținuți prin oxidarea parafină. Oxidarea este efectuată sub barbotare de aer prin parafină topită în prezența oxidului de mangan, la 100 ° C,